一句话事件
9月15日,国家药监局药审中心正式发布《境外生产药品再注册申报程序、申报资料要求和形式审查内容》(2020年第26号),为境外生产药品再注册的申报程序、申报资料要求和形式审查内容提供政策依据。
境外生产药品再注册程序日臻完善
我国药品再注册工作始于2002年发布的《药品注册管理办法》,首次提出药品再注册的概念:指对药品批准证明文件有效期满后继续生产、进口的药品实施的审批过程。2007年修订的《药品注册管理办法》第九章“药品再注册”从一百二十条至一百二十七条,对药品再注册的监管要求作出明确规定。
但药品再注册工作一直未能有细化的工作管理规范,来指导境内和境外生产药品再注册的具体工作。直至2017年11月,原国家药监局发布《总局关于发布药品注册受理审查指南(试行)的通告》,其中《进口药品再注册核准受理审查指南》(试行)进一步明确了境外生产药品再注册核准受理审查要点。

2020年3月30日正式发布的新版《药品注册管理办法》是一个历史节点,对境外生产药品再注册做出了框架性规定,配套的操作文件于4月30日及时出台征求意见稿,并在9月15日发布正式文件。
配套新《药品注册管理办法》
承接新版《药品注册管理办法》,新的境外生产药品再注册程序进行了更为详细的规定。例如再注册审需要在有效期届满前六个月向药审中心提出再注册申请,批时限为一百二十日(技术审评时限一百日,行政审批时限二十日)。在审查环节中,将再注册与注销环节衔接,不予再注册后,需要报请国家局注销药品注册证书。

相比4月30日发布的征求意见稿,新的境外生产药品再注册程序在“申报资料要求”和“形式审查”中,将制剂和原料药分开规定和要求,明确规定原料药需要再注册,并且在第三部分“形式审查”中,有更加细化的流程和模板要求。
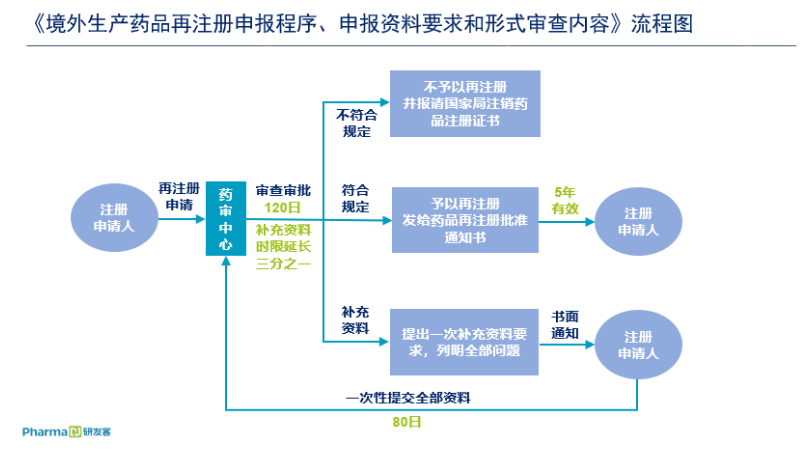
理顺再注册和补充申请的职责权限
境外生产药品再注册程序在第三条规定“境外生产药品再注册申请中原则上不能同时申请其他补充申请事项。如需要申请的,可单独申请,审评时根据需要关联审评或分别进行审评。”
原2017年发布的《进口药品再注册核准受理审查指南》(试行)中,再注册时可同时申请其他补充申请事项。但不应同时申报改换产地、增加药品规格的补充申请,改换产地、增加药品规格必须按照补充申请的程序单独申报。
此次修订,明确规定了再注册期间不能申报补充申请,理顺和明确了补充申请和再注册的职权权限。药品再注册的重点是对品种在5年生产周期内的质量和安全有效性的再评价,申请人提供的资料均应是经过备案或审批过的内容,药品注册申请人不能通过再注册使处方工艺等变更的内容合法化。
依据新《药品注册管理办法》,补充申请在两种情况下可提出:一是药物临床试验申请、药物临床试验期间的补充申请;二是审批类变更的补充申请,包括注册期间的补充申请和上市后变更的补充申请。
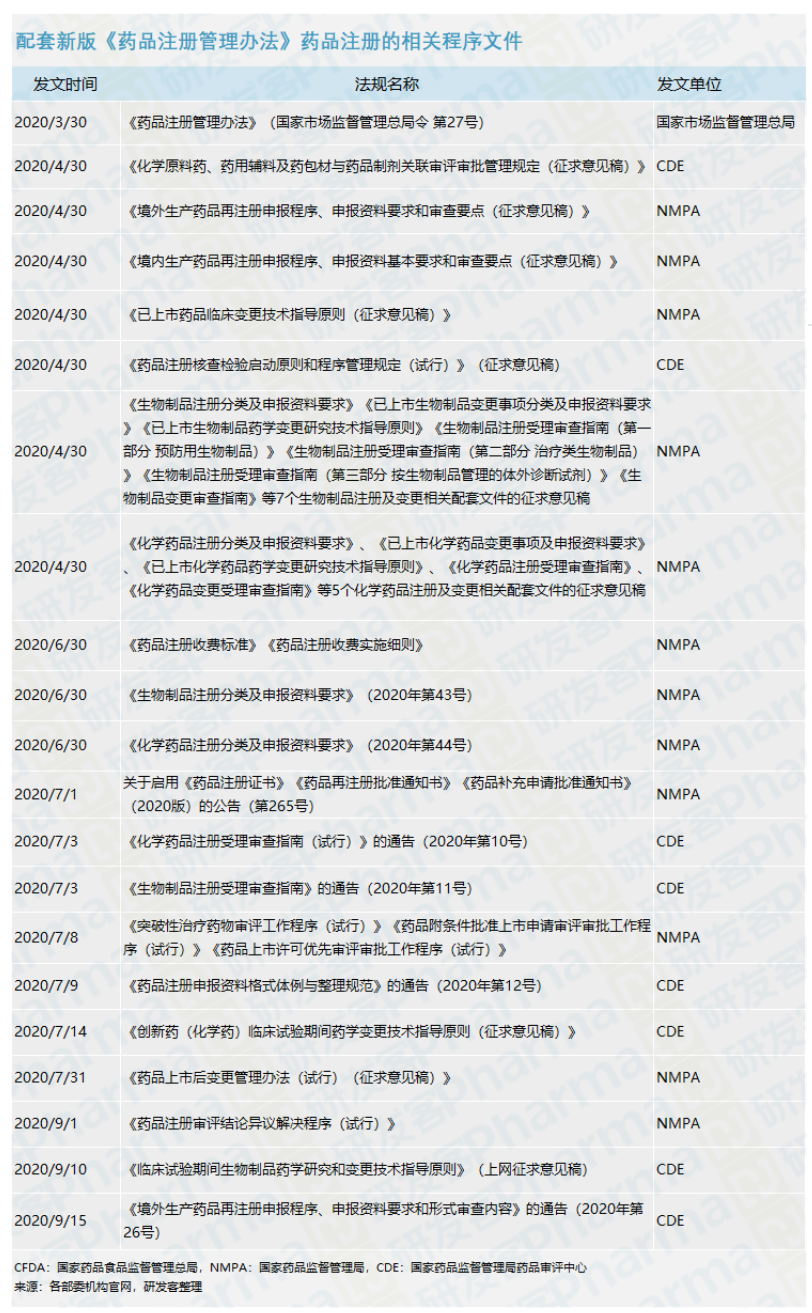
药品注册相关的政策文件汇总
在3月30日新版《药品注册管理办法》正式发布后,国家药监局和药审中心相继发布了数个与药品注册相关的征求意见稿、试行或正式实施的技术指导原则以及行政程序文件,体现了《注册管理办法》与配套文件的整体性和连接性,汇总如下表。
参考资料:
1.药品注册管理办法》学与践|新旧药品注册法规环境中境外生产药品再注册监管要求对比,爱康维健。
2.国家药监局药审中心关于发布《境外生产药品再注册申报程序、申报资料要求和形式审查内容》的通告(2020年第26号)
3.国家药品监督管理局、国家药品监督管理局药品审评中心网站
4.钟露苗,唐健元.有关药品再注册工作的思考与建议[J].中国药事,2017,31(07):722-726.



 110102000668(1)号
110102000668(1)号