大多数携带Bcr-Abl突变基因的慢性髓性白血病人,可以通过长期服用格列卫,从而实现带癌生存,就像患有高血压等慢性病的患者一样。然而,“神药”也有遗憾,就是其中一部分患者服药几年后,会产生耐药性。此时,就需要二代药物,当对二代药物也有耐药性后,则需要三代药物上场。
目前国内尚未批准第三代格列卫上市,因此,那些对一代、二代耐药的患者,根本是无药可医,只有接受风险高、难度大、且价格昂贵的骨髓移植一途。
如今,首个国产第三代格列卫落地在即。10月21日,亚盛医药宣布,其全资子公司广州顺健的1类新药奥瑞巴替尼片获国家药品监督管理局(NMPA)新药审评中心公示,符合临床急需新药的审评审批工作程序,正式被纳入优先审评。这意味该药的审批时间将缩短,市场准入将加快。
而在刚刚举行的全球最权威的血液学术盛会ASH(美国血液学会)年会上,奥瑞巴替尼的临床进展连续第三次入选口头报告,充分显示了国际血液学界对该药物安全性和疗效的认可。
亚盛医药董事长兼CEO杨大俊告诉生辉:“哪怕早一天批准上市,对病人都是非常有意义的”。

亚盛医药董事长兼CEO杨大俊
同时,在亚盛医药多条创新药研发管线中,奥瑞巴替尼是第一个申请新药上市的品种。对于2009年成立、致力于创新药研发的亚盛医药来说,这第一枪也至关重要。
首个国产第三代“格列卫”
2001年,是人类对抗慢性髓性白血病(CML)最重要的分水岭。这一年的5月,瑞士诺华开发的格列卫获得美国食品药品监督管理局(FDA)批准上市,成为治疗CML的一线药物。
在此之前,CML患者的五年生存率不到30%;格列卫上市后,这类患者的五年生存率跃升至90%。他们只要按时服药,就可以像其他人一样正常生活,CML成为一种可控的慢性疾病。
格列卫是第一代Bcr-Abl抑制剂,它开创了CML靶向治疗的时代。但是耐药性的出现,迫使生物医药公司要开发更多的新药。
很多患者在格列卫耐药之后,就得服用第二代Bcr-Abl抑制剂,但是过一段时间之后又会产生耐药。Bcr-Abl激酶区突变是获得性耐药的重要机制之一,其中T315I突变是常见的耐药突变类型之一,在耐药CML中的发生率高达25%左右。伴有T315I突变的CML患者对目前所有一代、二代Bcr-Abl抑制剂均耐药,因此第三代药物成为临床上的刚需。
在中国,CML患者面临更大的麻烦,就是用药选择非常少。国内真正上市的Bcr-Abl抑制剂只有一代格列卫和两种二代药物。目前,全球只有一款第三代药物帕纳替尼上市,而且尚未在中国获得批准。那些对一代、二代药物耐药的CML患者,困于无药可医的濒死边缘,往往仅剩几个月的生存时间。
亚盛医药本次在国内递交的奥瑞巴替尼上市申请如果获批,它将成为全球第二个三代Bcr-Abl抑制剂。它能够靶向不同种类的Bcr-Abl突变体,可以有效克服一代、二代药物的耐药缺陷。数据显示,它耐受性好,疗效显著,特别是对T315I突变的CML患者具有突出的疗效。此次,它正是以伴有T315I突变的CML作为适应症进行申报。
杨大俊表示,“我们期待这款药能够早日到达病人手中。因为做临床实验的病人数量是有限的,我们的关键Ⅱ期总共60例病人,整个完整的批准上市将近140个病人,但全国有几千上万的耐药病人,他们急需要用这个药。”
同时,杨大俊对这款药的期待不止于在中国获批上市,还要造福全球的CML患者。
2019年7月,该品种获美国FDA临床试验许可,直接进入Ib期临床研究。2020年5月,奥瑞巴替尼接连获得美国FDA授予的孤儿药资格和审评快速通道资格。
对此,杨大俊分析称,美国的CML病人比较少,因此奥瑞巴替尼拿到孤儿药的资质,这是保护、促进新药开发的政策;而审评快速通道的门槛则比孤儿药更高,要求有临床数据,要证明比现有的治疗方案好,亚盛医药基于中国的临床数据,顺利拿到了这一资格。杨大俊希望该药在中国批准上市后,经过两年左右,在美国或其他国家批准上市。
在市场竞争方面,奥瑞巴替尼将是国内首款上市的第三代BCR-ABL抑制剂,具有市场独占性优势。
在全球市场,它是帕纳替尼的潜在对手。
帕纳替尼于2012年获得FDA批准,是第一个上市的第三代BCR-ABL抑制剂。然而上市不到一年,帕纳替尼就因与“危及生命的血栓和血管重度狭窄”相关风险,于2013年10月31日被FDA要求暂停销售和推广。
同年12月20日,FDA经过风险效益评估后认为,由于帕纳替尼为T315I基因突变型CML患者的唯一选择,在严格的安全控制措施之下,使用该药治疗利大于弊。因此,FDA通过限制适应症、添加了黑框警示与治疗相关的动脉血栓形成和肝脏毒性风险,在安全监控下再次批准其上市。
未来,如果亚盛医药通过进一步的临床数据证明,奥瑞巴替尼优于帕纳替尼方案,则在全球也有很强的市场前景。
20余年磨一药
在亚盛医药的产品战略中,如果说奥瑞巴替尼将打响公司新药上市第一枪,那么,针对Bcl-2靶点开发治疗癌症的一系列抑制剂,则是被寄予厚望的重炮。
要知道,杨大俊团队聚焦于Bcl-2靶点研发药物已有20余年时间。
这还得从细胞凋亡说起。细胞凋亡和人类疾病的产生有紧密关联,比如癌症就与细胞凋亡直接相关。1984年,科学家发现细胞凋亡途径中的一种重要蛋白Bcl-2蛋白,它在人类的多种肿瘤组织和细胞中都存在超出正常水平的过表达,高表达的Bcl-2可阻止细胞凋亡,使细胞生长加速,进而导致恶性肿瘤的发生。因此,科学家推测,如果能够抑制Bcl-2的表达,也许能实现治疗肿瘤的目的。
于是,Bcl-2抑制剂的研发迎来一波爆发。但是针对该靶点的药物开发却始终困难重重,除了三年前开发的Venetoclax之外,还没有其它药成功。
据统计,2010-2019年共有5款Bcl-2抑制剂进入了临床研究阶段,分别是Oblimersen、Navitoclax(ABT-263)、Venetoclax(ABT-199)、Obatoclaxmesylate(GX15-070)、AT-101,其中只有Venetoclax于2016年在美国获批上市。
Venetoclax的开发历经20年,从化合物设计、筛选直到临床试验,不断地克服障碍,不断地推倒重来,其面对的困难是整个领域的共性难题,其经历的波折几乎代表了整个领域的沉浮。
除了Venetoclax之外,全球层面还没有其它针对Bcl-2靶点的药获批上市。
对于杨大俊团队而言,同样是风风雨雨的20余年。
1995年,杨大俊受聘加入乔治敦大学Lombardi综合癌症中心,担任生物化学和分子生物学副教授、肿瘤学副教授和高级研究员。杨大俊当时的工作是做抗肿瘤新药的发现,研究乳腺癌,Bcl-2只是当时的对照组。
1996年,雅培发的一篇文章解析了Bcl-2的结构。这引起了杨大俊及王少萌教授(现亚盛共同创始人、首席科学顾问)的注意,他们利用计算机模拟筛选能够与Bcl-2口袋结合的小分子,并在1998年,发现了第一个化合物AT-101。
2003年,杨大俊、王少萌以及MarcELippman教授在美国成立了亚生(Ascenta),开始做以AT-101为主的Bcl-2药物的临床开发,也因为这样的一个机遇,他们进入了Bcl-2这个领域。2005年,亚生中国研发中心在上海张江成立。
一年的时间将AT-101推入临床,为亚生带来的是累计高达1亿美元的3轮融资。但在金融危机的影响下,亚生在美国IPO停滞,中国的亚生研发中心也面临关闭。
“但是我们也通过系统化合物建立了一套生物学、药理学的测试体系,在优化之后,我们就可以很快的做出筛选,选出成交性很好、又相对安全有效的化合物”杨大俊告诉生辉。
在亚生中国研发中心的基础上,杨大俊、王少萌、郭明成立了亚盛医药,继续专注创新药的研发。同时,亚盛医药也在改进其它化合物带来的限制性问题。
其中,APG-1252是选择性的抑制Bcl-2和Bcl-xl的产品,主要针对实体瘤。但是Bcl-xl会在成熟的血小板上进行表达,所以APG-1252在杀肿瘤细胞的时候会杀伤血小板,导致血小板降低。当时,雅培第一个进入临床的产品ABT-263也有这个问题,也是因为这一问题,雅培没能继续ABT-263的开发。
在了解细胞凋亡和它在肿瘤发生以及治疗中的作用后,亚盛医药花费了两年的时间解决了血小板降低这一难题。目前,针对APG-1252的研究也已进入临床II期。
而APG-2575是亚盛医药自主研发的新型口服Bcl-2选择性小分子抑制剂,通过选择性抑制Bcl-2蛋白来恢复肿瘤细胞程序性死亡机制(细胞凋亡),从而达到治疗血液及实体肿瘤的目的。APG-2575对Bcl-2具有高度的选择性。APG-2575穿过细胞膜进入细胞后与线粒体膜上的抗凋亡蛋白Bcl-2结合,阻断Bcl-2与促凋亡蛋白BIM形成蛋白-蛋白复合物,释放出BIM,后者进一步激活细胞凋亡的一系列程序,最终导致肿瘤细胞凋亡。
APG-2575是首个在中国进入临床阶段的、本土研发的Bcl-2选择性抑制剂。作为单药,APG-2575对于Bcl-2依赖的肿瘤细胞具有强的抗肿瘤活性,并且与其他抗癌药物组合表现出更广泛的抗肿瘤活性。
APG-2575现已获得美国、中国、澳大利亚、欧洲多项临床试验许可,正在全球同步推进多个血液肿瘤适应症的临床开发。
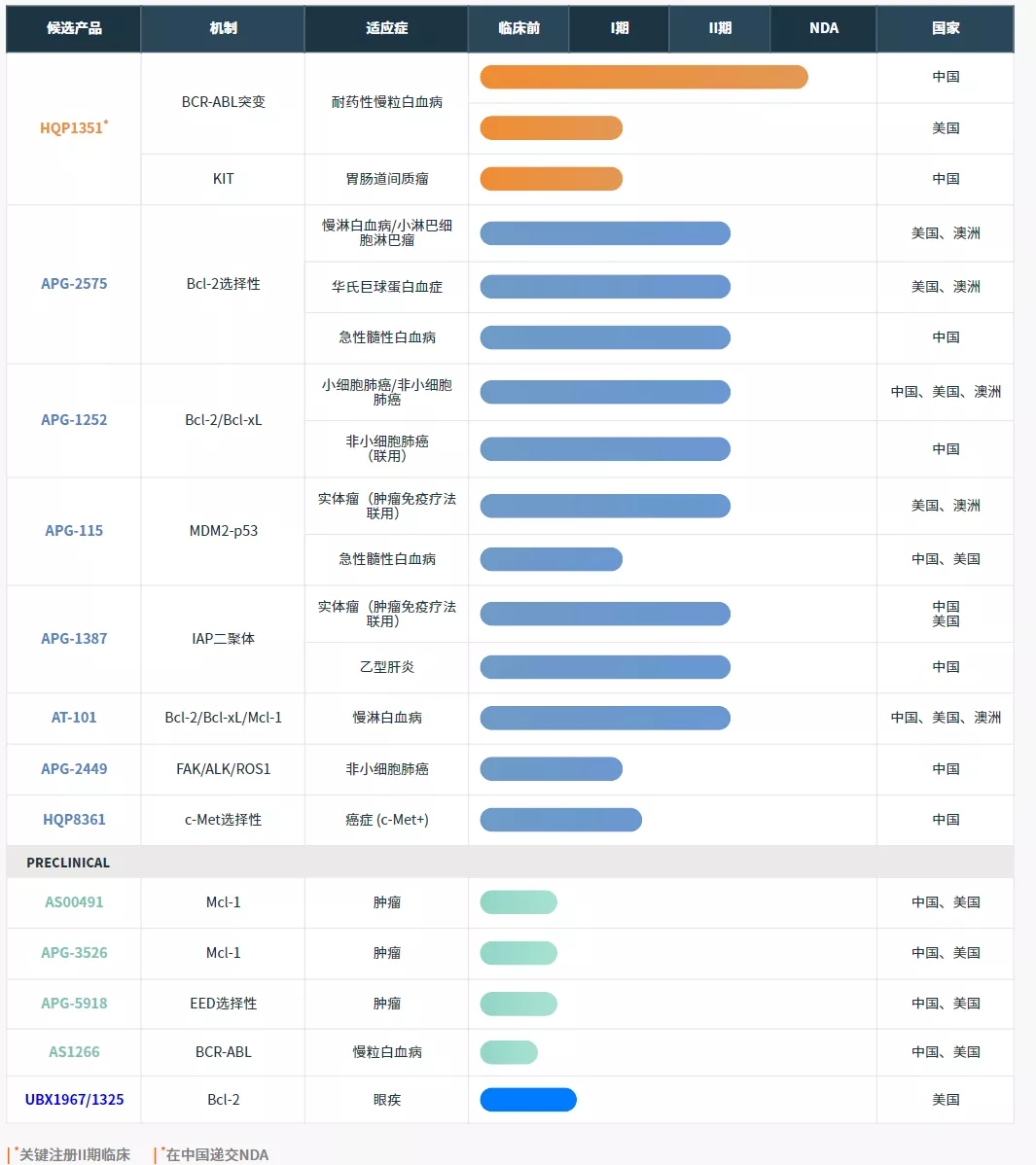
亚盛医药研发管线(来源:公司官网)
如今,在亚盛医药的管线中,包括8个处于临床阶段的小分子候选药物在内的丰富在研产品线,在美国、澳洲及中国有超过40项I期或II期临床试验正在进行中。
在全球,解决未满足的新药需求
欧美国家有多年的创新药研发经验,但是大部分开发的适应症并没有关注中国常见的肿瘤,比如肝癌、胃癌、鼻咽癌等。而在中国男性的十大肿瘤中,这三种癌症占到了肿瘤病人的一半。
国外创新药在中国上市,平均要晚5-7年,即使是引进来的新药,也无法覆盖中国的高发癌种。在中国,由于相关法规的问题,新药领域也会出现“卡脖子”的问题。因此,未被满足的临床需求变成了需要迫切解决的问题。
作为最早一批回国、按照国际标准做研发的制药人,杨大俊清楚的认识到当时的中国创新药领域的形势:创新药需求很大,但缺少人才、缺少投资,环境既有劣势也有优势。
同时,亚生的失败也为他带来了两点宝贵的经验教训。
第一,亚生是美式打法。美国的生物科技初创公司通常是投资人占主导,尤其是在很多重大问题上。投资人可以带来资源,使你加速成长,但会让你失去对公司的控制。生物医药是个高风险、长周期行业。如果投资人的心态是短平快,操之过急,就会造成一些不合理的判断。
第二,临床开发最好全球同步。这样能够充分利用中国的患者资源、美国的技术和FDA的各种优越性,以加快临床开发,少走弯路。
因此,亚盛的定位首先是控股,能够让这个领域对公司产品和技术最了解的专业人士计划、推进临床研发。
在产业界如此成功的情况下,杨大俊也没有放弃学术,他表示,“自始至终,我最重要的初衷还是希望能够为中国新药研发,特别是转化医学培养学生。我招的学生基本上都是临床医生或是医学院毕业的,他们有兴趣做转化研究。而且,我也可以通过兼职做博导教授,花一些时间和精力去研究中国人高发癌症和临床的需求”。
与此同时,杨大俊也参与了很多的社会活动。在美国时,杨大俊是华人生物医药科技协会(CBA)的创始成员之一。回国后,担任新药创始人俱乐部副会长。
杨大俊表示,这样做有两个方面的原因。一是通过交流、分享,在中国创新药的生态链中共同成长;二是希望通过协会的影响和组织,共同促进部分政策法规的提高。
新药产品能在全球批准上市的重要前提是,首先在中国上市,这就需要审批部门的支持。“希望在监管科学的情况下,能够大胆支持创新药”。杨大俊告诉生辉。
而亚盛也确实抓住了机会,在港交所推行“新政”之际,亚盛提交了上市申请,并成为2019年港股市场上的“超购王”。杨大俊分析说,首先是亚盛上市前,市场有一段低迷的时期,上市窗口比较好;其次,亚盛是第一个真正做小分子创新药的公司,大家比较认可亚盛的技术和产品。
没有产品却成功上市,亚盛的成功不可复制。
“未来,希望在政府以及监管部门的支持下,让我们的产品能够有专利的保护,在全球进行临床试验,在全球上市。成为一家从研发、生产到销售的制药公司,并且是以中国为基础的跨国公司。”杨大俊说道。



 110102000668(1)号
110102000668(1)号