但由于血-骨髓屏障的存在,骨髓原发灶中的血药浓度很难在不产生全身副作用的前提下达到目标浓度,因此当前的化疗常常遗留微小病灶,导致AML复发率高、预后差,五年生存期仅为30%。因此,将阿霉素等药物靶向运输到骨髓中对癌变造血干细胞进行治疗十分关键。
另一方面,通过表面归巢受体与血管内皮细胞表面黏附因子相互作用使细胞回到特点部位的现象叫做“归巢”,造血干细胞普遍具有这一特征,即使白血病中发生癌变的白血病细胞也仍然保持着归巢回到骨髓的特质。这一特质提供了将该种细胞作为载体,从而实现药物突破血-骨髓屏障从而定向输送到骨髓治疗白血病等相关疾病的可能。为解决这一问题,浙江大学顾臻教授团队提出利用处理后的无致病性的AML“死细胞”构建具有骨髓靶向功能的递药系统,以提高以阿霉素为代表的化疗药物在骨髓内的富集,从而实现更加有效的对AML细胞的抑制。同时借助AML“死细胞”本身所携带的肿瘤相关抗原,联合免疫佐剂(adjuvant),刺激机体对AML癌细胞的特异性免疫识别及杀伤。
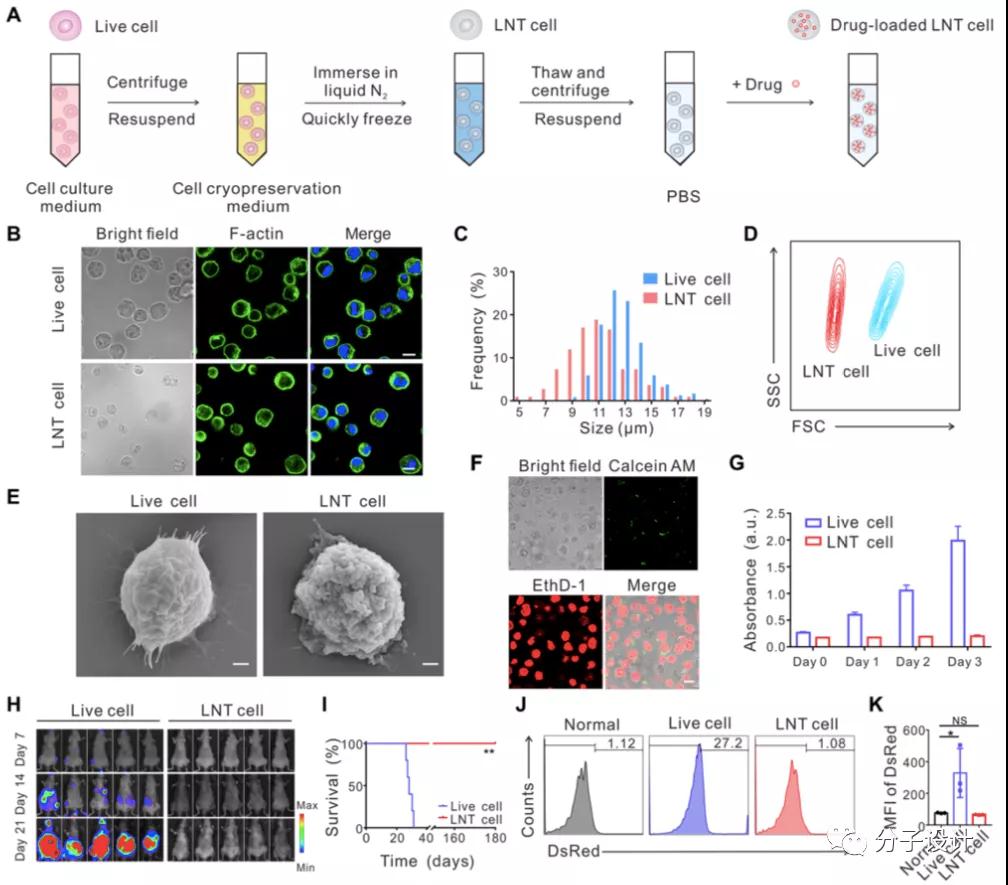
该策略的关键就是得到无致病性的AML“死细胞”。而这一目标的实现则是在由液氮处理(liquid-nitrogen treated,LNT)“快冻快融”实现。由此研究人员得到了具有与活细胞相似结构特征的LNT细胞。结合共聚焦显微镜,流式等方法,研究人员进一步确定了相关LNT细胞已经丧失生理活性,不具备增殖分化功能,且无致病性。
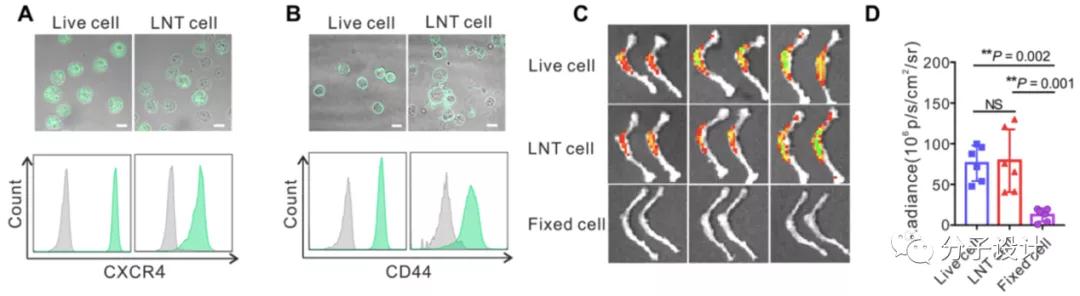
那么要将LNT细胞利用作为递要载体,一个重要的方面就是看其“骨髓归巢”的活性是否保留。通过对“骨髓归巢”相关重要趋化因子CD44和CXCR4的检测以及体内LNT细胞归巢活性测量,研究人员确定了制备所得的LNT细胞归巢能力被较好的保留,明确了LNT细胞确实能作为一个靶向性递药系统。
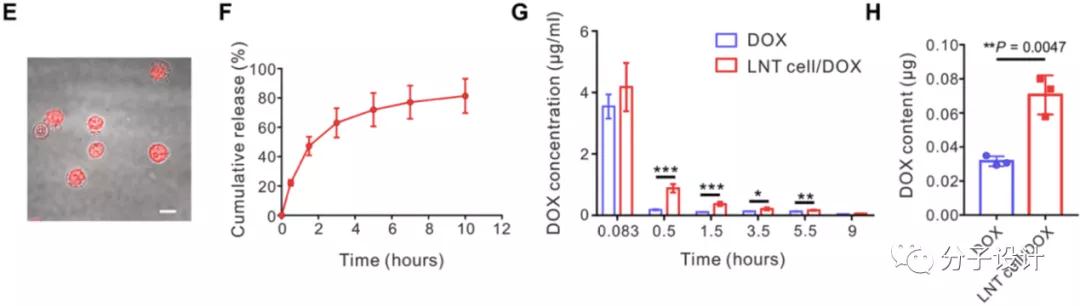
由此,利用阿霉素与DNA的插层结合以及其与LNT细胞内其他物质的相互结合吸引,研究人员将LNT细胞与阿霉素共孵育,得到了65 ± 16 μg/1 × 10^7 LNT细胞的载药系统(LNT 细胞/DOX),实现了骨髓病灶阿霉素的富集。而由于阿霉素与DNA的可逆结合,这一体系也具有药物缓释的特征,使得相关组织在较长时间内维持较高治疗浓度,并且该体系在体内实验中也被证实能够抑制肿瘤发展。
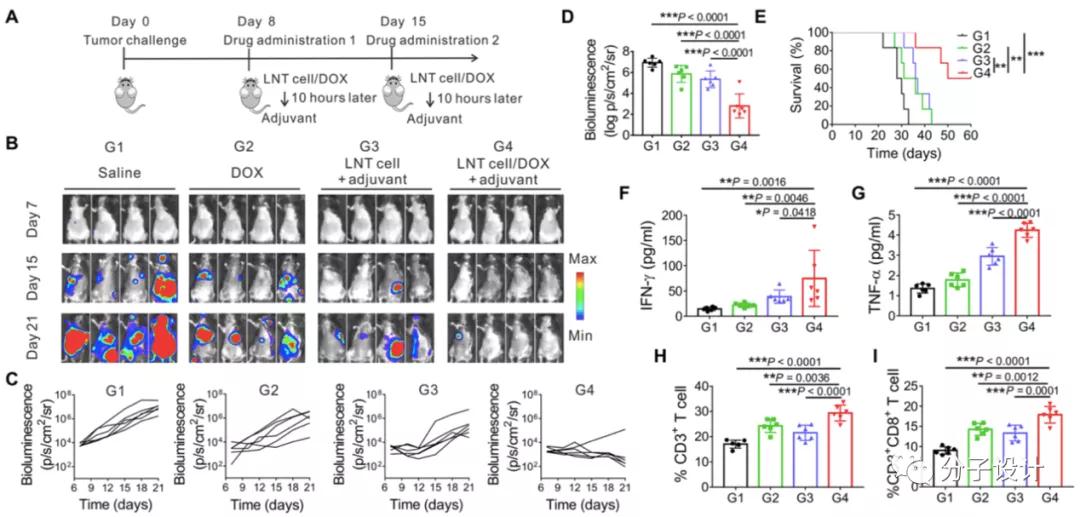
另一方面,癌细胞碎片可以用来作为癌症免疫疗法的刺激剂,那么LNT细胞同样作为死细胞,携带有AML细胞相关癌症抗原,或许能刺激更强的免疫反应,从而联合阿霉素等药物实现更好的治疗效果。研究者对这一猜想进行了测试。在对AML小鼠模型进行阿霉素,LNT细胞+免疫佐剂,LNT细胞/DOX+免疫佐剂,通过免疫相关炎性介质IFN-γ,ΤΝF-α水平的升高,以及外周中CD3,CD8阳性T细胞数量的增加,以及相关小鼠模型的存活现象,研究人员证实了LNT细胞能够与阿霉素一同实现免疫化疗的可能性
此外,研究人员也在体内体外验证了利用携带AML相关抗原的LNT细胞作为疫苗预防AML发生的能力。利用该液氮处理方法形成的自身细胞靶向递药系统,具有更好的生物相容性,有望应用于其他疾病的治疗,为患者带来福音。
参考文献
1. Frederick, C. A.; Williams, L. D.; Ughetto, G.; van der Marel, G. A.; van Boom, H. J.; Rich, A.; Wang, A. H. J. Structural Comparison of Anticancer Drug-DNA Complexes: Adriamycin and Daunomycin. Biochemistry 1990, 29 (10), 2538–2549.
2. Ci, T.; Li, H.; Chen, G.; Wang, Z.; Wang, J.; Abdou, P.; Tu, Y.; Dotti, G.; Gu, Z. Cryo-Shocked Cancer Cells for Targeted Drug Delivery and Vaccination. Sci. Adv. 2020, 6 (50), eabc3013.



 110102000668(1)号
110102000668(1)号