9月8日讯 2020年9月2日,国家药监局最新批准了信达生物制药(苏州)的阿达木单抗注射液,商品名苏立信,成为第三个国产阿达木单抗生物类似药,将与百奥泰的格乐立、海正的安健宁同台角逐阿伯维的原研品牌药修美乐。
阿达木单抗是一款抗免疫类、抗炎类处方药物,2019年艾伯维的阿达木单抗全球市场为191.69亿美元,而在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端,艾伯维的阿达木单抗销售额仅为8000万元左右。随着国产阿达木单抗生物类似药的上市,将逐渐改变阿达木单抗在生物工程药物市场沉睡局面。
2020年抗体新药上市加快步伐
迄今为止,2020年国家药监局(NMPA)注册进口和批准国产抗体新药达到了14个,相比2019年同期的8个超过了75%。2020年9月2日,最新批准了信达生物制药(苏州)的阿达木单抗注射液后,我国自主开发上市用于临床的抗体类药物已有22个,而近3年获批上市的品种占据了60%以上。
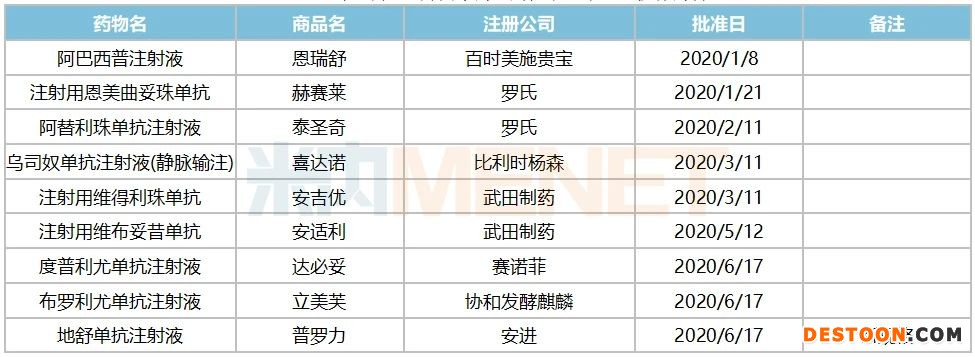
数据显示,国内总共注册用于临床的进口抗体药物已达39个。2018年~2020年8月底批准注册进口抗体药物为26个,超过前18年的1倍。2020年至今,批准注册了9个进口单克隆抗体药物,已达到2019年全年注册量。
据国家药监局数据显示,截至目前,2020年NMPA已批准了5个国产单克隆抗体药物,分别是三生国健药业(上海)的抗HER2乳腺癌靶向创新药物注射用伊尼妥单抗,国内的抗体类生物类似物是上海复宏汉霖生物的利妥昔单抗注射液、注射用曲妥珠单抗,信达生物制药(苏州)的贝伐珠单抗注射液和阿达木单抗注射液。
表1:2020年1~9月国家药监局批准的国产抗体药物
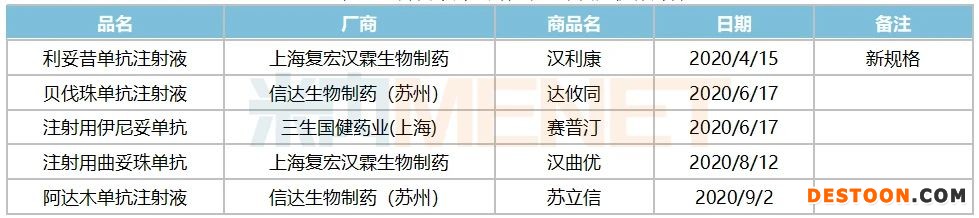
表2:2020年1月~9月国家药监局批准的进口抗体药物
在全球医药研发管线中,单克隆抗体药物备受瞩目,其特异性高、靶向性强和毒副作用低等特点,受到了诸多药企的追捧,属于最热门的研发领域之一。2020年1~8月底美国FDA已经批准上市7个单抗药物,全球单抗药物超过了90多个,有望向百个单克隆抗体迈进。
据不完全统计,中国上市临床的生物工程抗体类药物及抗体诊断试剂达到50个,国产生物工程抗体类药物有了突破性发展,而众多生物工程大分子药物处于开发及审批中。
国内抗体市场快速发展
据米内网数据,2019年重点省市公立医院终端使用的抗体药物有38个品种,用药金额超过72亿元,同比上一年增长了36.25%。国内总体市场已超过200亿元。
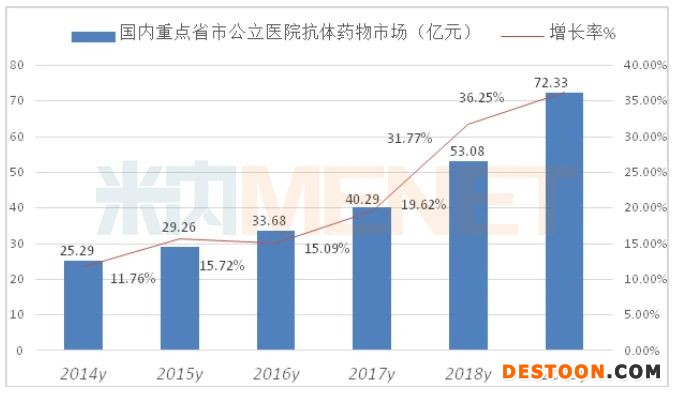
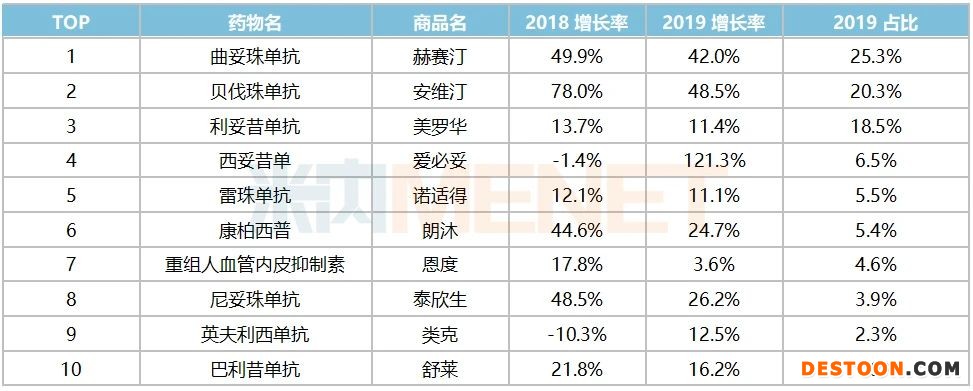
重点省市公立医院终端抗肿瘤单抗占据了抗体用药的半壁江山,使用的TOP10抗体药物占据了总体市场的94.23%。其中居前3的品种是曲妥珠单抗、贝伐珠单抗和利妥昔单抗,市场份额分别为25.32%、20.26%和18.51%。
表3:2019年国内重点省市公立样本医院TOP10抗体占比
曲妥珠单抗领军国内抗体市场
曲妥珠单抗是第一个批准用于治疗转移性乳腺癌和早期乳腺癌的人表皮生长因子受体2(HER2)的单克隆抗体,广泛用于各期HER2阳性乳腺癌治疗。2019年罗氏公司全球曲妥珠单抗和恩美曲妥珠单抗市场为74.32亿瑞士法郎,成为罗氏的领军品种,2019年罗氏的3个靶向HER2抗体原研药曲妥珠单抗、帕妥珠单抗、恩美曲妥珠单抗市场达到110亿瑞士法郎。
2020年8月12日复宏汉霖的曲妥珠单抗(HLX02)正式获得批准上市,商品名汉曲优。全球受抗体类药物生物类似药冲击,导致了国外赫赛汀销量呈下滑,但国内市场增长依然坚挺,呈现出逐年增长态势。
据米内网数据,2019年重点省市公立医院终端曲妥珠单抗用药金额为18.32亿元,同比上一年增长41.96%,由2017年抗体类药物排序第2名登上榜首。
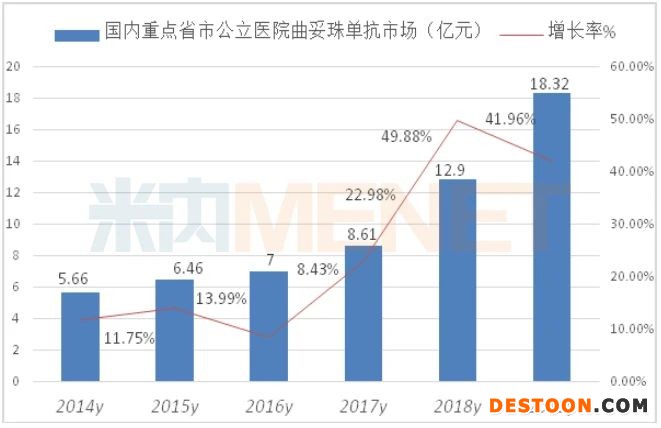
数据显示,2019年中国公立医疗机构终端曲妥珠单抗已超过55亿元规模,随着国产曲妥珠单抗生物类似药的上市,价格将进一步亲民化,从而满足国内患者的需求。公开数据显示,截至2020年上半年,有7家本土药企的曲妥珠单抗已进入III期临床,分别是嘉和生物、海正药业、正大天晴、上海生物制品研究所、安科生物、华兰基因、艾迈医疗,未来竞争局面将拭目以待。
贝伐珠单抗居抗体中老二
贝伐珠单抗是美国基因泰克公司开发的品种,目前已是瑞士罗氏旗下的当家品种之一。贝伐珠单抗是世界上第一个抗肿瘤血管生成药物的抗肿瘤靶向制剂,2004年2月,美国FDA首先批准贝伐珠单抗为转移性结直肠癌治疗药物,商品名Avastin。随着其临床适应症的拓宽,美国FDA先后批准贝伐珠单抗用于非小细胞肺癌(NSCLC),以及肾细胞癌、结肠直肠癌和胶质母细胞瘤。2012年底,欧盟获准用于复发性卵巢癌,贝伐珠单抗已经在全球120多个国家和地区获得批准。2019年全球罗氏的贝伐珠单抗销售额70.73亿瑞士法郎,比上一年增长3.27%。
2019年12月6日,齐鲁制药的贝伐珠单抗生物类似物获NMPA批准,商品名安可达。随后2020年6月17日信达生物制药(苏州)的同品上市,商品名达攸同,目前形成三家入市局面。
据米内网数据,2019年重点省市公立医院终端贝伐珠单抗用药金额14.66亿元,同比增长48.50%,中国公立医疗机构终端贝伐珠单抗约在35亿元市场规模。
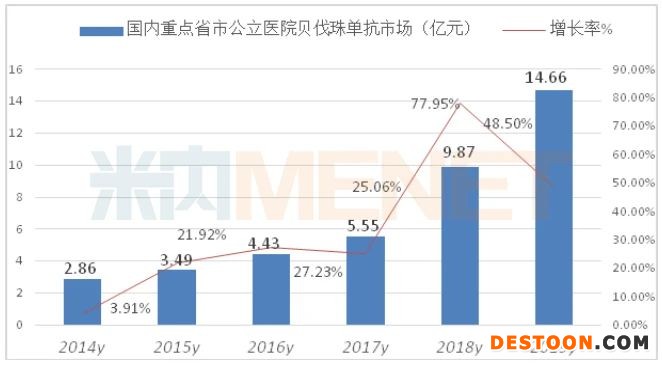
第三匹黑马利妥昔单抗
利妥昔单抗(Rituxan)是美国基因泰克公司研制的药物,1997年11月美国FDA批准上市,商品名为Rituxan/Mabthera,现已是罗氏公司旗下的骨干品种。利妥昔单抗是作用于人类CD20的单克隆抗体,其主要表现于B淋巴球细胞表面,可用来治疗因B淋巴球过多所造成的疾病,包括淋巴癌、白血病、移殖排斥和某些自体免疫疾病。利妥昔单抗是治疗非霍奇金氏淋巴瘤的金标准药物,同时被已批准作为晚期结肠癌的一线用药。2019年全球罗氏的利妥昔单抗销售额64.77亿瑞士法郎,比上一年下滑4%。2000年中国批准利妥昔单抗上市,商品名为“美罗华”。
2019年2月22日,国家药监局批准上海复宏汉霖生物制药的利妥昔单抗注射液(100mg/10ml)上市申请,商品名汉利康,该药是国内获批的首个生物类似药,主要用于非霍奇金淋巴瘤的治疗。随后于2020年4月15日批准上海复宏汉霖生物制药的利妥昔单抗注射液(500mg/50ml)上市申请。根据相关数据显示,正大天晴、信达生物、华兰基因等企业都有布局。
据米内网数据,2019年重点省市公立医院终端利妥昔单抗用药金额13.39亿元,同比上一年增长11.35%,中国公立医疗机构终端达到了41.29亿元市场规模。
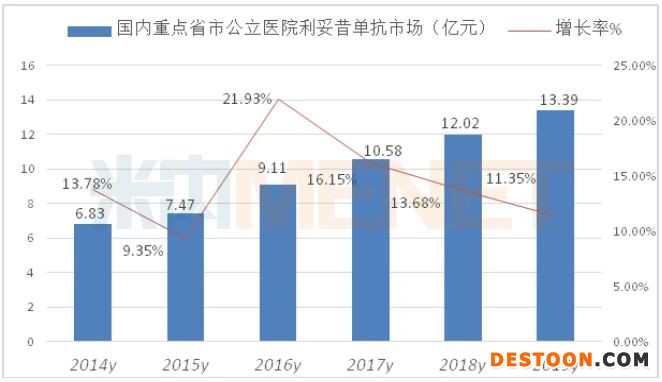
国内研发的单抗多集中在曲妥珠单抗、贝伐珠单抗、利妥昔单抗、阿达木单抗等几个热门品种,随着研发的纵深发展,复星子公司上海复宏汉霖、信达生物、三生国健、百奥泰、齐鲁制药、江苏奥赛康、桂林三金等企业均有相关品种的研发布局。新一轮国产高品质抗体药物上市,将改变传统化药主力格局。
来源:米内网数据库



 110102000668(1)号
110102000668(1)号