通告指出,经江西省药品检验检测研究院等9家药品检验机构检验,标示为成都锦华药业有限责任公司等10家企业生产的10批次药品不符合规定。
梳理发现,10批次不合格药品中,有7批次为制剂,分别为吡嗪酰胺片、兰索拉唑肠溶片、注射用炎琥宁(有2个批次)、柴黄颗粒、明目上清片、维血宁颗粒;3批次为饮片,分别为广藿香、黄精、秦艽。
对于以上9种不合格药品,国家药监局已要求相关企业和单位采取暂停销售使用、召回等风险控制措施,对不符合规定原因开展调查并切实进行整改。
同时,国家药监局明确,相关省级药品监督管理部门要依据《中华人民共和国药品管理法》,组织对上述企业和单位生产销售假劣药品的违法行为立案调查,并按规定公开查处结果。
具体不合格药品情况及名单如下:
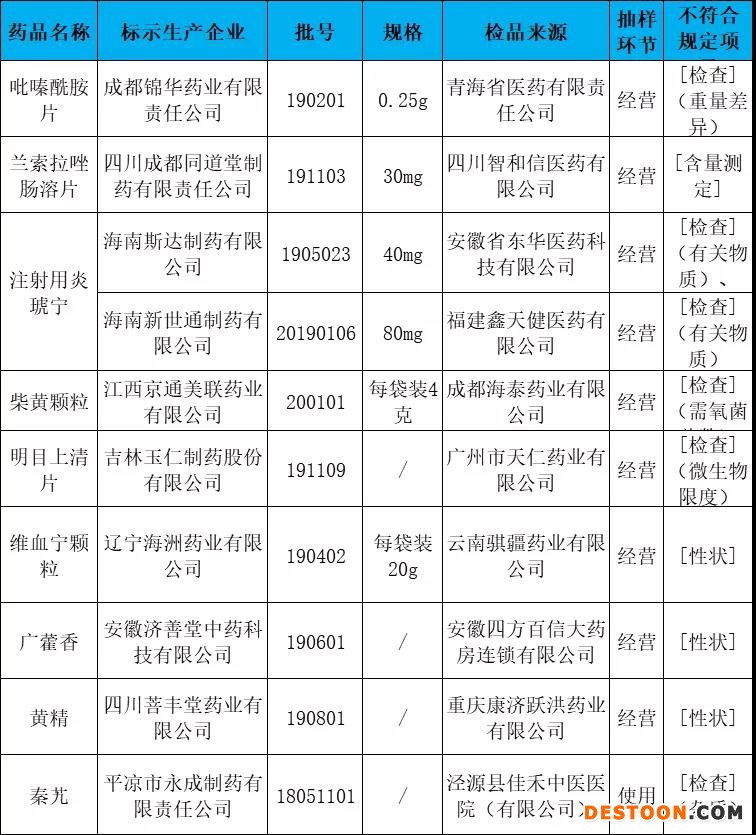
经江西省药品检验检测研究院检验,标示为成都锦华药业有限责任公司生产的1批次吡嗪酰胺片不符合规定,不符合规定项目为重量差异。
经江苏省食品药品监督检验研究院检验,标示为四川成都同道堂制药有限责任公司生产的1批次兰索拉唑肠溶片不符合规定,不符合规定项目为含量测定。
经河南省食品药品检验所检验,标示为海南斯达制药有限公司、海南新世通制药有限公司生产的2批次注射用炎琥宁不符合规定,不符合规定项目包括有关物质、水分。
经北京市药品检验所检验,标示为江西京通美联药业有限公司生产的1批次柴黄颗粒不符合规定,不符合规定项目为需氧菌总数。
经福建省食品药品质量检验研究院检验,标示为吉林玉仁制药股份有限公司生产的1批次明目上清片不符合规定,不符合规定项目为微生物限度。
经湖南省药品检验研究院(湖南药用辅料检验检测中心)检验,标示为辽宁海州药业有限公司生产的1批次维血宁颗粒不符合规定,不符合规定项目为性状。
经中国食品药品检定研究院检验,标示为安徽济善堂中药科技有限公司生产的1批次广藿香不符合规定,不符合规定项目为性状。
经安徽省食品药品检验研究院检验,标示为四川菩丰堂药业有限公司生产的1批次黄精不符合规定,不符合规定项目为性状。
经山西省食品药品检验所检验,标示为平凉市永成制药有限责任公司生产的1批次秦艽不符合规定,不符合规定项为杂质。
附:不符合规定项目的小知识
一、重量差异系反映药物均匀性的指标,是保证准确给药的重要参数之一。
二、含量测定项系指用规定的试验方法测定原料及制剂中有效成分的含量,一般可采用化学、仪器或生物测定方法。
三、有关物质是指药品中的有机杂质,是反映药品纯度的指标,主要来源为制备过程中带入的杂质和药品在贮存或运输中发生降解产生的杂质。
四、水分系指药品中的含水量。水分偏高通常与工艺、包装不当以及储运环境等因素有关。
五、微生物限度系对非直接进入人体内环境的药物制剂的微生物控制要求。由于此类制剂用药的风险略低,可以允许一定数量的微生物存在,但不得检出一些条件致病菌。微生物限度分为计数检查和控制菌检查两部分。
六、性状项下记载外观、臭、味、溶解度以及物理常数等,在一定程度上反映药品的质量特性。中药饮片性状项不符合规定,可能涉及药材种属偏差、炮制工艺有瑕疵、储存不当等。
七、中药饮片中混存的杂质系指下列各类物质:来源与规定相同,但其性状或药用部位与规定不符的;来源与规定不同的;无机杂质,如砂石、泥块、尘土等。



 110102000668(1)号
110102000668(1)号