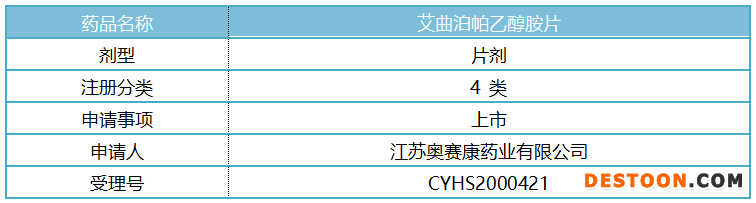
表1:药品基本情况
来源:公司公告
图1:艾曲泊帕的全球销售情况(单位:百万美元)

来源:米内网跨国上市公司销售数据库
据悉,艾曲泊帕乙醇胺片是诺华公司开发的一种非肽类血小板生成素受体激动剂,2008年11月获得FDA批准上市,用于治疗既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性免疫性(特发性)血小板减少症(ITP)。它是首个治疗ITP的口服药物,给药更加方便,患者依从性高,明显降低出血率,维持ITP患者的血小板计数,减少输血。美国批准的适应症范围更广泛,除用于ITP成人,还批准用于一岁以上患儿。
米内网数据显示,2019年艾曲泊帕全球销售额超过14亿美元。原研艾曲泊帕乙醇胺片于2017年12月获批进入中国,商品名为瑞弗兰,2019年在中国城市公立医院、县级公立医院、城市社区中心及乡镇卫生院(简称中国公立医疗机构)终端销售额超过1800万元。
图2:艾曲泊帕乙醇胺片国内上市申请情况

来源:米内网一键检索
公告中提到,江苏奥赛康药业是该产品国内第一家完成了临床生物等效性研究递交生产注册申请的企业,米内网数据显示,奥赛康分别在2020年1月及6月申报过艾曲泊帕乙醇胺片的4类仿制上市申请,目前两个受理号均在审评审批中。
来源:米内网数据库、公司公告
审评数据统计截至2020年7月1日,如有错漏,敬请指正。



 110102000668(1)号
110102000668(1)号