撰文| Enron Medicine
小分子药物的发展由来已久,现代制药行业从1930s年代脱胎于染料行业以来,小分子药物就占据了举足轻重的地位。从抗菌药物百多息(Prontosil)到今年9月被FDA批准用于治疗非小细胞肺癌的Pralsetinib,小分子药物在感染、肿瘤、心脑血管、自身免疫和中枢神经系统等领域内发挥了巨大的作用。
大分子药物(包括多肽类和蛋白质类)中多肽类药物的发展时间轴几乎与小分子药物并行,其最初主要是从天然来源中分离出一些活性多肽物质(如在1921年从牛的胰腺中提取胰岛素用于糖尿病的治疗)来进行所谓的“替代疗法”,即往体内输入外源性的活性物质来补充体内某种活性物质的缺乏或缺失的一种疗法1。而蛋白质类药物则发展相对较晚,但却发展迅速。在1970s年代初期,起源于斯坦福大学的DNA重组技术使得人们可以将基因引入不相关的有机体之中来表达目标蛋白,而这项技术也为蛋白质药物的发展铺平了道路2。直到1982年,第一款蛋白质类药物Muromonab CD3才被获批上市,它是一款鼠源性的、靶向CD3的抗体药物,用于器官移植时急性排斥反应的治疗。
优良苗头化合物一票难求
在新药研发的过程中,小分子药物相比于大分子药物而言存在一个天然的劣势,那就是性能优良的苗头化合物的“一票难求”。小分子药物在发现过程中的苗头化合物完全依赖于已有的化合物,而已有的化合物库都是来源于天然产物的分离纯化或人工合成,它们有很多局限性,化合物的性能质量参差不齐,从中找到理想的苗头分子需要耗费大量的时间和金钱。而多肽类药物的苗头分子大多是基于已知的体内活性物质(目前也有通过筛选多肽类分子库3或噬菌体展示技术来找到苗头分子的发现策略),作为一个苗头分子,它的性能质量很高。
蛋白质类药物,尤其是抗体类药物,则是通过模拟自然界的亲和力成熟过程来主导整个发现阶段,这个过程对起始抗体的性能质量的要求并不是很高,最终抗体分子的成药性更多是依赖于整个筛选和评价体系。
GLP-1是一类肠促胰岛素激素,顾名思义,它是由肠道的内分泌细胞合成释放并进入体循环的一类多肽类激素,其主要作用靶点是GLP-1R,后者分布于小肠、胰腺、心血管、脑和唾液腺等组织中。GLP-1R属于GPCR(G蛋白偶联受体),可活化多种G蛋白(如Gas, Gi/o, Gq等)从而引发下游的生物信号。
如在胰腺中,活化的GLP-1R可促进b细胞的增殖和胰岛素的释放从而起倒降糖的作用。除了G蛋白之外,GLP-1R还可招募b-Arrestin 1分子,其在下游信号(如ERK活化)和受体脱敏等方面发挥着重要的作用。由于GLP-1R的广泛表达,GLP-1R激动剂有许多潜在功能,可用于治疗糖尿病、肥胖、心脑血管疾病等多种类型的疾病4。

靶向GLP-1R的策略
由于GLP-1R的下游信号分子丰富多样、受体活化形式多样(比如存在时空多态性5)和组织表达的差异化等因素,目前靶向GLP-1R的策略包括:直接激动剂、正向別构调控剂和偏向激动剂。其中正向別构调控剂通过靶向受体的別构位点,使得受体转为活性构象的能垒降低,从而可以增强内源性的低活性GLP-1R激动剂(如GLP-1(9−36)NH2)或人工合成的小分子直接激动剂的生理活性。偏向激动剂的目标是得受体活化之后更多的招募Ga蛋白而不是b-Arrestin,从而最大化的增强其促胰岛素分泌的能力6。目前,正向別构调控剂和偏向激动剂仍处于早期的研究阶段,尚没有化合物进入临床阶段,本文不再赘述,下文专注于GLP-1R的直接激动剂。
GLP-1R直接激动剂的发展较早,自从1987年发现GLP-1可以刺激胰岛素的分泌依赖,人们就开始尝试利用GLP-1来治疗2型糖尿病7。然而遗憾的是,GLP-1在体内易被DPP-4降解失活,导致其半衰期约为2 ~ 3分钟,这就限制了其作为药物的使用。直到1992年,人们从吉拉毒蜥的唾液中分离出了一种GLP-1类似物Exendin-4,它可以激活人体内的GLP-1R且不易被DPP-4降解。最终在2005年,人工合成的Exendin-4(也就是Exenatide)被FDA批准用于辅助治疗2型糖尿病的血糖控制8。
至今,共有6款GLP-1类似物被FDA批准上市,它们在给药周期、安全性和有效性等方面都各有不同。国内方面,仁会生物在2016年获批了一款短效的GLP-1R激动剂贝那鲁肽(其实就是人工合成的GLP-1(7-36)),用于餐时的血糖控制。其次就是豪森制药于2019年获批的聚乙二醇洛塞那肽,它也是首款国产的长效GLP-1类似物。
GLP-1类似物不仅可以降低血糖,还可以抑制胃排空、增加饱腹感、降低食欲,进而减轻体重。更重要的是在临床还观察到了这类GLP-1类似物可以降低血压和低密度胆固醇的水平,并且降低心血管不良事件的发生风险(包括心血管死亡、非致死性心肌梗死和非致死性卒中等)9。然而在临床上大约有30%–50%的患者使用GLP-1类似物后会出现胃肠道副反应(如恶心、呕吐和腹泻),虽然相比于短效的GLP-1类似物而言,长效的GLP-1类似物的肠道副反应发生率更低,但是它仍然是限制其使用剂量的关键因素6。
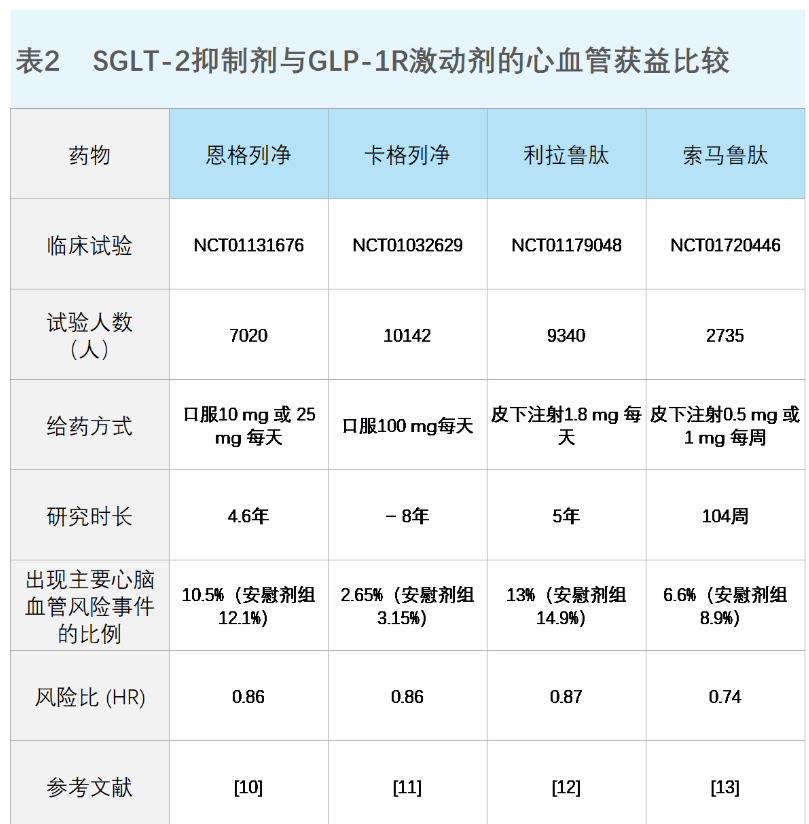
突围:更优安全性和有效性
小分子激动剂替代多肽类GLP-1类似物一个明显优势在于它可以口服给药,从而避免皮下注射的不适感,增加患者的依从性。然而这个优势在安全性和有效性面前,患者会不会为之买单呢?此外,去年9月份索马鲁肽的口服片剂已上市,增加了这个优势能否成立的不确定性。因此,小分子GLP-1R激动剂要想在众多的多肽类GLP-1类似物中突围成功,就需要从更好的安全性和有效性,或更低价格(在保证类似有效性和安全性的前提下)上入手。在有效性方面,相比于多肽类药物而言,小分子药物更容易透过血脑屏障,并作用于下丘脑弓状核中的GLP-1R而降低食欲14,最终可能会起到更优的减轻体重的效果。当然,小分子GLP-1R激动剂的安全性和有效性,需要更多药理学上和临床数据来证实。
小分子GLP-1R激动剂的开发起步早,但进展缓慢。由于GLP-1R属于B类GPCR,这类GPCR的特点是有一个较大的N端胞外域,其正构位点呈面积较大的、较深的V状结构,而且受体需要发生特定的构象改变才能活化,因此开发小分子GLP-1R激动剂是一件相当困难的事情15。如前所述,小分子药物研发过程中的一个劣势就是性能优良的苗头分子的“一票难求”,这在开发小分子GLP-1R激动剂上显得尤为明显。
进入临床的三款GLP-1R直接激动剂
2007年,上海药物所王明伟课题组筛选了将近5万个化合物后,得到了首个体内有效的GLP-1R小分子激动剂Boc516。然而,这个化合物的结构复杂且药代性质不佳,经口服给药(小鼠: 250 mg/Kg; 大鼠: 20 mg/Kg)后,其血药浓度极低17。而为了开发小分子替代药物,辉瑞更是在筛选了280万个化合物之后,才得到了一个进入临床试验的候选药18,其中的艰难可想而知。虽然道路坎坷,目前有3款小分子GLP-1R直接激动剂准备进入/进入临床试验。

1. OWL833
OWL833是由日本中外制药开发的小分子GLP-1R激动剂,其预测的人体内的口服生物利用度为30%,半衰期约为18小时。此外,经口服给药后,不仅可以降低食蟹猴的血糖水平,并且可以降低其食物的摄入量19。2018年9月27日,礼来宣布与日本中外制药达成一项交易,前者以5000万美元的首付款获得OWL833的全球开发和商业化权益。然而,至今尚没有OWL833进入临床试验的消息。
2. PF-06882961
如前所述,辉瑞在付出了巨大的努力之后,最终在2017年将小分子GLP-1激动剂PF-06882961推上了临床试验。在今年6月份的美国糖尿病协会科学年会上,辉瑞公布了PF-06882961的一项I期临床研究结果(NCT03538743)20。结果显示,在患有2型糖尿病的患者中,联合二甲双胍,每天2次给药PF-06882961(从10 mg/Kg至120 mg/Kg),持续28天之后,给药组空腹血糖和24小时内平均血糖水平均有下降。更为重要的是,给药组的体重有了明显的减轻(从2.4 Kg到7.9 Kg不等),而且副反应都较温和,最常见的仍是胃肠道副反应。粗略的来看,高剂量组(70 mg/Kg和120 mg/Kg组)仅仅在4周的时间内,减重方面的效果就可以与注射型索马鲁肽(给药时长为30周至104周不等)相媲美21,前景可期。目前,PF-06882961正在开展II期临床试验,期待它的好结果。
3. TTP273vTv
Theraputics(前身是TransTech Pharma)是一家位于美国北卡罗来纳州的临床研究阶段的生物医药公司,公司目前专注于用小分子药物来治疗未被满足的临床需求,包括阿尔兹海默病、糖尿病和炎症性疾病。早在2012年,这家公司就有一款小分子GLP-1R激动剂TTP054进入了临床研究(NCT01665352)。
结果显示,每天1次口服给药(从200 mg至800 mg)后,其HbA1c水平下降1%且整体上TTP054是安全且耐受的。然而在2015年公司战略性重新评估后,他们放弃了TTP054,而是选择将活性和安全性更加优异的第二代候选药TTP273继续推上II期临床试验22。TTP273的II期临床试验在2017年已经结束。据C&EN报道,在试验剂量下,临床结果显示药物是安全的,然而在降低HbA1c水平和体重方面的结果并没有达到公司的预期23。
此外,今年1月份发表在《自然》(Nature)上的一篇文章显示,TTP273的临床阻碍在于难以找到最优的给药剂量24。晶体结构显示,TTP273类似物TT-OAD2与GLP-1R的结合位点与GLP-1明显不同,结合实验和功能实验显示TT-OAD2是一个別构的、偏向(cAMP偏向)型GLP-1R激动剂。以前的计算机模拟和实验结果也显示TTP273是一个別构的、偏向型激动剂25。2017年12月,国内的华东医药以800万美元的首付款购买了TTP273包括中国和其他16个环太平洋国家在内的开发和商业化权益。华东医药于2019年在国内将TTP273推进了临床,后续的结果尚待公布。
在制药领域,小分子替代大分子永远是一个时髦的话题。然而小分子药物相比于大分子药物的一些优势能否真正赢得医生和患者的心,还需要每一个新药研发者认真对待。小分子GLP-1R激动剂的开发走过了一段很长的幽暗岁月,如今随着PF-06882961的I期临床试验结果的公布而曙光乍现。下一步,还在路上……
作者简介:
Enron Medicine是一个初入医药研发职场的医药人,读博期间养成了阅读文献的习惯,手上做的是化学,脑子里想的是信号通路,说出来的都是前人的足迹。希望有生之年可以做出让老百姓用得起的好药。
参考文献
1. Bioorganic & Medicinal Chemistry. 2018, 26, 2700–2707.
2. Drug Discovery Today. 2015, 20, 393-398.
3. Mol Cancer Ther. 2015, 14, 480–490.
4. Trends Endocrinol metab. 2016, 27, 427-438.
5. Biochem Soc Trans. 2016, 44, 582–588.
6. Nature Communications. 2018, 9:1602.
7. J Clin Invest. 2017, 127, 4217-4227.
8. Nature Reviews Drug Discovery. 2005, 4, 713 - 714.
9. Circulation. 2017, 136, 849–870.
10. N Engl J Med 2015, 373, 2117-2128.
11. N Engl J Med 2017, 377, 644-657.
12. N Engl J Med 2016, 375, 311-322.
13. N Engl J Med 2016, 375, 1834-1844.
14. J Clin Invest. 2014, 124, 4223-4226.
15. J Biol Chem. 2016, 291, 10700–10715.
16. Proc Natl Acad Sci USA. 2007, 104, 943-948.
17. Acta Pharmacologica Sinica. 2012, 33, 148–154.
18. Peptides. 2020, 125, 170225.
19. Diabetes. 2018, 67 (Supplement 1), 1118-P.
20. Diabetes. 2020, 69 (Supplement 1), 353-OR.
21. Diabetes & metabolism. 2019, 45, 409–418.
22. Expert Opin Investig Drugs. 2017, 26, 219-225.
23.https://cen.acs.org/pharmaceuticals/biologics/oral-form-blockbuster-diabetes drug-has-arrived/97/web/2019/12
24. Nature. 2020, 577, 432-436.
25. https://vtvtherapeutics.com/wpcontent/uploads/pdf/GLP1_poster_animation_Keystone_CO_FINAL.pdf



 110102000668(1)号
110102000668(1)号