值得注意的是,被收GMP的这两家药企,均为中药饮片生产企业。而且,两家药企均是被投诉举报而遭此横祸。
中药饮片企业频被收证
在近日各省接二连三发布的收回GMP公告中,亦是已中药饮片企业居多。据不完全统计,4月底至今,不到一个月的时间,已有9家药企被收回GMP证书,其中有7家为中药饮片企业。
中药饮片企业被收GMP的公告频出,结合前两年被收回GMP的企业来看,可以发现,中药饮片成为“收证”重灾区的形势并未改变。可见,各省药监部门已经明显加强对中药饮片生产及流通的整治,我们也可以预见,中药饮片企业淘汰赛已经拉响。
举报横行,药企屡屡遭罚
上文提到,黑龙江近日收回GMP的两家药企,是投诉举报的功劳。
近年来,飞检对于药企而言可以说已经是家常便饭了。而飞检的力度大家也心知肚明。然而,谁也没有想到,到了2016年,举报横空出世,成了飞检的一大功臣。药企因举报被收回GMP或者GMP认证不通过的例子,迄今为止已经有超过10家药企因投诉举报被飞检,遭受严厉处罚。
从举报的成果来看,让我们佩服的是,群众举报威力实在太大,简直是一举报一个准。众多举报的群众中,当然也可能包括业内的同行或竞争对手。
有了投诉举报这一招后,未来通过GMP认证和在未来监管中,恐怕是要遭受更加严格检查了。
为何中药饮片企业屡屡中招?
据报告分析,截至2015年上半年,全国中药饮片生产企业有972家,虽然数量众多,但行业集中度较低,企业间竞争日趋激烈。中药饮片生产企业普遍规模偏小,小型企业占绝大多数。
被收回GMP证书中药饮片企业,将面临停产、产品召回等诸多问题。如果经历多次认证仍未成功,其还将面临被收购,甚至破产关闭的局面。这也是近年来药监部门对于中药饮片企业疯狂收证后想要看到的局面。
药监部门在严格要求中药饮片生产企业的同时,鼓励其进行兼并重组,部分规模小、竞争力较弱、管理不规范的生产企业将逐步被市场所淘汰。随着行业的不断发展和优势企业竞争力的提升,中药饮片行业集中度也将逐步提高。



以下是近期被收GMP证书药企的汇总:
黑龙江省
黑龙江省收回药品GMP证书公告(2016年第02号)
黑龙江鹤祥春中药饮片有限公司、哈尔滨宇泰药业有限公司严重违反《药品生产质量管理规范》规定,依据《药品生产质量管理规范认证管理办法》第三十三条规定,我局依法收回其《药品GMP证书》,现予以公布。

检查发现问题:
黑龙江鹤祥春中药饮片有限公司:
一、检验设备不能满足所生产的中药饮片全检要求。
如液相色谱仪缺少黄芪饮片检验使用的蒸发光检测器,现场未见生物显微镜;
二、涉嫌编造检验记录。
(一)批号为150601和150604柴胡饮片含量检验数据完全一致;黄芪、黄芩、刺五加药材与饮片检验数据完全一致;
(二)企业生产的刺五加、黄芪、黄芩、柴胡等中药饮片检验记录中没有相应的中药材和中药饮片检验图谱;
(三)在企业化验室未见有生产中药饮片的对照品、对照药材,现场看到的黄芩苷对照品溶液、柴胡皂苷a、d混合液未标示配制日期;
三、留样管理混乱。
2015年生产的柴胡、羌活、藁本、赤芍、白鲜皮、板蓝根、防风、橘核、黄芪、黄芩、刺五加中药饮片没有留样;百合、地黄留样无留样标识;
四、生产的部分品种未进行工艺验证。
哈尔滨宇泰药业有限公司:
一、药材和饮片未按规定检验。检查企业检验用对照品及其台账,没有部分对照品和对照药材,但检验报告中出具了检验结果;
二、物料管理混乱,入库、发放不可追溯。部分中药材如夏枯草包装袋已破损,地面洒落大量药材;多数物料均无相应货位卡;许多药材外包装无任何标识信息;原料库内标识划分不清,不能有效区分合格区和待验区;部分药材没有保管账;
三、成品未按规定放行,出库不可追溯。企业成品库内大部分品种货位卡与实际库存数量不符,货位卡上没有产品出库过程,成品库房没有成品审核放行单和检验报告单;
四、企业未建立销售记录;
五、部分生产品种未进行工艺验证。
广西壮族自治区
收回药品GMP证书公告(2016年第1号)
广西汇粹药业有限公司因严重违反《药品生产质量管理规范》规定,依据《药品生产质量管理规范认证管理办法》第三十三条规定,我局依法收回其《药品GMP证书》,现予以公布。

涉嫌违法违规行为:
一、对部分原药材入厂未按规定进行检验。如桔梗(批号:150601)、金银花(批号:150801)、陈皮(批号:150601)、山银花(批号:160101)等原药材的含量测定。
二、对部分成品未按规定全检即销售。如天麻(批号:20151201)、大黄(批号:20150201)、炙甘草(批号:20150601)的含量测定;甘草(批号:20150601)的重金属及有害元素、有机氯农药残留量等的检验。
三、购进中药饮片直接分装销售。从广西益生堂药业有限公司购进甘草切片(批号:20150501)(圆片或斜片)直接分装销售。
四、批生产记录不真实,编造生产记录。如批号为20150801(规格:圆片,包装规格:0.5kg/袋和1kg/袋)、20150501(规格:圆片,包装规格:0.2kg/罐)等多批次的甘草批生产记录,以及批号为20150601(规格,圆片,包装规格:0.5kg/袋和2kg/袋)、20150701(规格,斜片,包装规格:0.5kg/袋)等多批次的炙甘草批生产记录,批号为20150501、20150601(规格:段)的丹参批生产记录等,这些产品都是以切片为起始原料,但其批生产记录中也编上有净选、洗润、切制等药材加工操作岗位记录,且记录中所有工序涉及有关人员的签名都不是其本人签署。
五、伪造检验报告书。如批号为20150601的甘草(规格:圆片)有2份成品检验报告书(产量不一致);批号为20150901的金银花中重金属和有害元素的项目未检验,但成品检验报告书上显示重金属和有害元素符合规定。
六、质量管理混乱,质量保证体系未能有效运行,放行审核形同虚设。企业的质量受权人没有认真履行成品质量审核职责,如批号为20150601的甘草(规格:圆片)、批号为20150601的炙甘草、批号为20150501、20150601的丹参等的放行审核没有经质量受权人唐昌审核,《成品审核放行单》上审核人“黄有丽”、质量部经理“唐昌”的签名,均不是其本人签署。
广西收回药品GMP证书公告(2016年第2号)
广西圣民制药有限公司因严重违反《药品生产质量管理规范》规定,依据《药品生产质量管理规范认证管理办法》第三十三条规定,我局依法收回其《药品GMP证书》,现予以公布。

涉嫌违法违规行为:
一、生产所用的原料无法追溯
(一)提取车间所使用的中药材来源不明。银翘解毒颗粒(批号160301)于2016年3月4日由提取车间使用薄荷、荆芥、连翘、金银花、桔梗、淡竹叶、甘草、淡豆豉、牛蒡子(炒)等9味原料进行投料生产,而仓库的台帐、货位卡上均无上述原料的出库记录,仓库内也没有留存有相应的领料单,除了连翘、淡竹叶、甘草外,薄荷、荆芥、金银花、桔梗、淡豆豉、牛蒡子(炒)等6 味原料在2016年1月31日前已经没有库存;黄芩片(批号160301)于2016年2月19日由提取车间使用黄芩3350kg进行投料生产,而中药材仓库的台帐、货位卡上均无黄芩的出库记录,仓库内也没有留存有黄芩的领料单。
(二)批生产记录中没有标明中药材的批号。银翘解毒颗粒(批号160301)、黄芩片(批号160301)的批生产记录中对所使用的中药材均没有标明批号。
二、编造批生产记录
(一)批生产记录的投料量与实际产量严重不符。银翘解毒颗粒(批号160301)批生产记录的投料总数为5万袋(每袋15g),而洁净区的颗粒干燥间、暂存间、分装间共存放有银翘解毒颗粒(批号160301)84桶(每桶28kg,共计2352kg,可分装成15.68万袋),外包间存放有已完成中包装工序的银翘解毒颗粒(批号160301)120件(每件15g×10袋×120盒,共计14.4万袋),产量总计30.08万袋;黄芩片(批号160301)批生产记录投料总数为100万片,而洁净区中间体暂存间存放有黄芩素片(批号160301,片重0.25g)16桶(每桶50kg,共计800 kg、320万片)、黄芩片颗粒(批号160301)12桶(每桶85kg,共1020Kg,可压片408万片),压片间存放有黄芩片颗粒(批号160301)5桶(每桶85kg,共425Kg,可压片170万片),产量总计898万片。
(二)提前设定成品数量。银翘解毒颗粒(批号160301)的内分工序尚未全部完成,而批生产记录上已标明“成品数量:41件28盒”;黄芩片(批号160301)尚未开始包糖衣,而批生产记录上已标明“成品数量:27件5大盒(入库)”。
广东省
4月29日,广东省食药监局发布了2016年第5号飞行检查通报,深圳市东江制药有限公司因存在严重缺陷4项,主要缺陷4项,被收回GMP证书。
具体信息如下:
企业名称:深圳市东江制药有限公司
生产地址:深圳市龙岗区平湖街道山厦路71号园区1栋厂房
检查单位:深圳市食品药品监管局
检查日期:2016年4月7日
事由:日常监督检查
检查发现的主要问题
中药饮片生产不符合药品GMP要求,存在严重缺陷4项,主要缺陷4项。严重缺陷摘要如下:
一、编造检验记录。两个检验员于2015年10月入职,但该两名人员在2015年9月26日、27日的大黄素对照品使用记录上签名。
二、物料管理混乱。生产车间(筛选间)、中间产品库、退货区、冷库、药材常温库放置的药材及中间产品无物料标识。
三、批生产记录不完整,不具可追溯性。151201批制何首乌、151201批酒苁蓉的筛选工序、内包装工序、标签打印使用记录为空白,切制、烘干、蒸制等工序为铅笔填写。
四、产品放行不符合规范要求。未经审核,151201批制何首乌、151201批酒苁蓉已出库;151101批天麻于2015年12月6日经质量受权人签字同意放行,现场检查时筛选间正在进行该批产品的贴签操作,现场未能提供生产记录。
处理措施
一、鉴于深圳市东江制药有限公司不符合药品GMP要求,根据药品GMP管理的有关规定,省局决定收回该公司中药饮片(净制、切制、蒸制、炒制、炙制)的《药品GMP证书》(证书编号GD20150382)。
二、要求深圳市食品药品监管局督促企业改正,并加强日常监管工作。
山东省
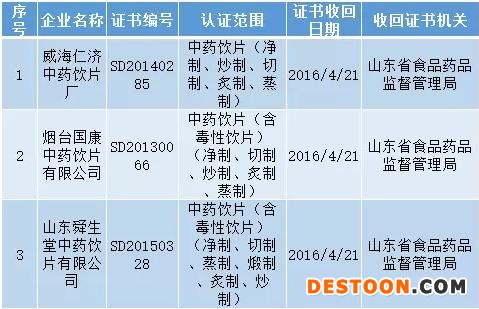
威海仁济中药饮片厂等3家药品生产企业严重违反《药品生产质量管理规范》规定,依据《药品生产质量管理规范认证管理办法》第三十三条规定,我局依法收回其《药品GMP证书》,现予以公告。

安徽省
4月25日,安徽省食药监局发布了《安徽省食品药品监督管理局关于收回安徽艾珂尔制药有限公司药品GMP证书的批复》,同意滁州市食品药品监督管理局《关于建议收回安徽艾珂尔制药有限公司药品GMP认证证书的请示》,经研究,现批复如下:
一、同意收回安徽艾珂尔制药有限公司《药品GMP证书》(编号为:AH20150215和AH20150216)。
二、责成你局对该企业违反《药品管理法》、《药品生产质量管理规范》的行为进行依法查处,立即召回已销售的“萘敏维滴眼液”产品,对库存“萘敏维滴眼液”产品进行查封。
三、请你局约谈该企业,监督企业按照药品GMP要求进行全面整改,
请你局接文后,立即通知该企业上缴药品GMP证书,并于一周内送交省局。查处、召回和监督整改情况请于5月底前报省局。



 110102000668(1)号
110102000668(1)号