8月21日讯 8月18日,海思科发布公告称,2款1类创新药迎新进展:HSK7653片III期临床试验获得伦理批准,HSK3486乳状注射液临床申请获得国家药监局受理;此外,6类仿制药注射用醋酸卡泊芬净获批生产。
HSK7653片属于二肽基肽酶-4(DPP-4)的长效抑制剂,是海思科开发的具有自主知识产权的1类新药,拟用于治疗2型糖尿病。米内网数据显示,目前国内已获批上市的DPP-4抑制剂有5款,分别为西格列汀、沙格列汀、维格列汀、利格列汀和阿格列汀,原研药均已获批进口多年,首仿则相继在2019年、2020年获批上市。
图1:HSK7653片国内临床试验登记情况
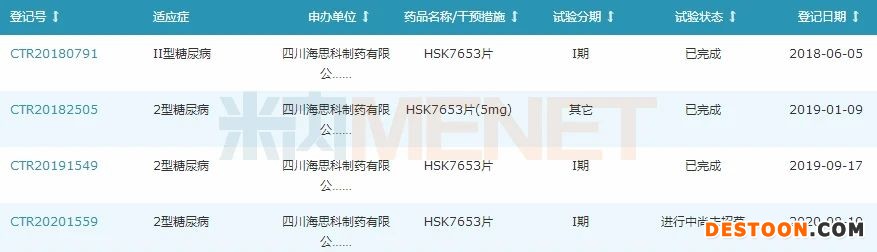
来源:米内网中国药品临床试验公示库
HSK7653片于2017年11月获批临床,2018年5月在北京协和医院开展I期临床,III期临床试验方案近期获得北京大学人民医院的伦理批准,计划2020年四季度开始筛选并入组患者。
HSK3486乳状注射液是海思科开发的全新的具有自主知识产权的1类新药,拟用于手术全麻诱导、内镜诊疗的镇静/麻醉、ICU 镇静等适应症。该产品是经典麻醉药丙泊酚的me-better,具有脂质用量显著降低、基本无注射痛、安全剂量宽等优势。
图2:HSK3486乳状注射液国内临床试验登记情况
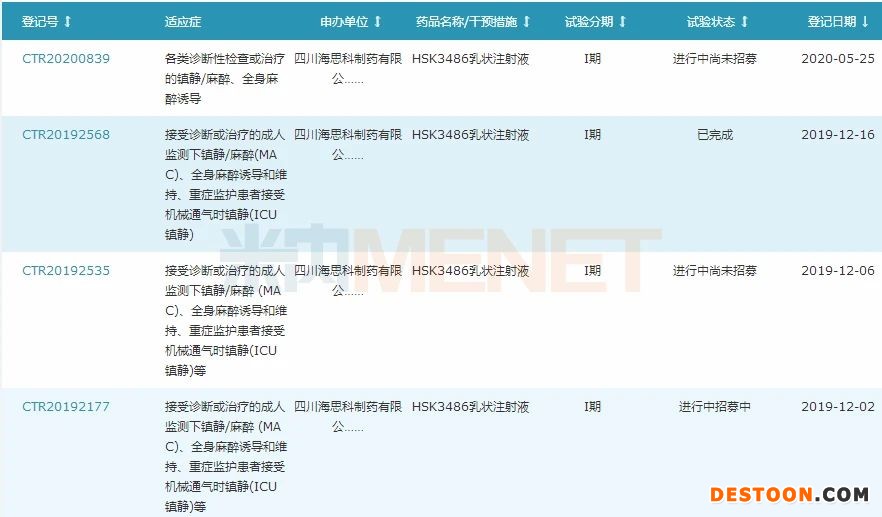
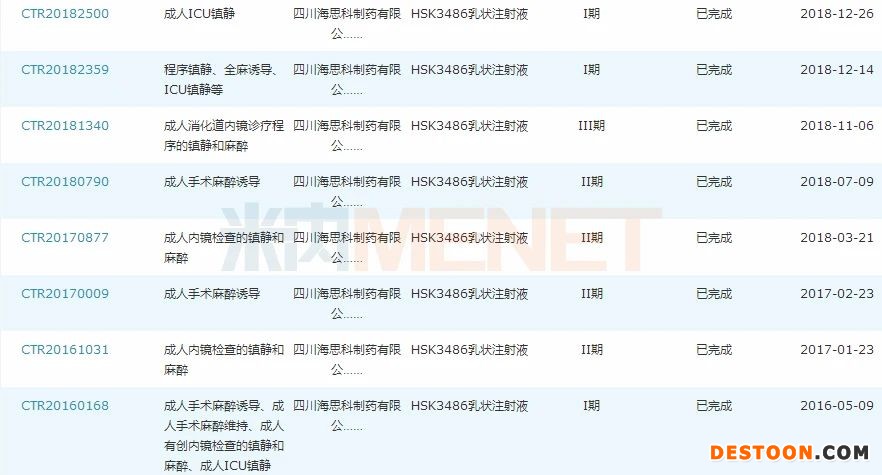

来源:米内网中国药品临床试验公示库
目前HSK3486乳状注射液已在国内登记18项临床试验研究,消化道内镜诊断和治疗镇静和/或麻醉、全身麻醉诱导2个适应症已完成III期临床并申报上市,且均被纳入优先审评,有望于2020年获批。此次获得国家药监局受理的的为适应症“全麻维持”Ⅲ期临床试验申请,若相关临床试验成功,将有望进一步拓宽该产品的适应症,增强市场竞争力。
注射用醋酸卡泊芬净属于棘白素类药物,具有抗菌谱广、半衰期较长、与人血清蛋白结合率高、不良反应较少、患者耐受性好等特点,是临床急需的抗深部真菌感染药。米内网数据显示,2019年中国城市公立医院、县级公立医院、城市社区中心以及乡镇卫生院(简称中国公立医疗机构)终端注射用醋酸卡泊芬净销售额超过20亿元,海思科为同品种第4家获得注册证书的国内企业,该产品也是海思科2020年至今首个获批上市的仿制药。
来源:米内网数据库、上市公司公告
注:数据统计截至8月19日,如有疏漏,欢迎指正!



 110102000668(1)号
110102000668(1)号