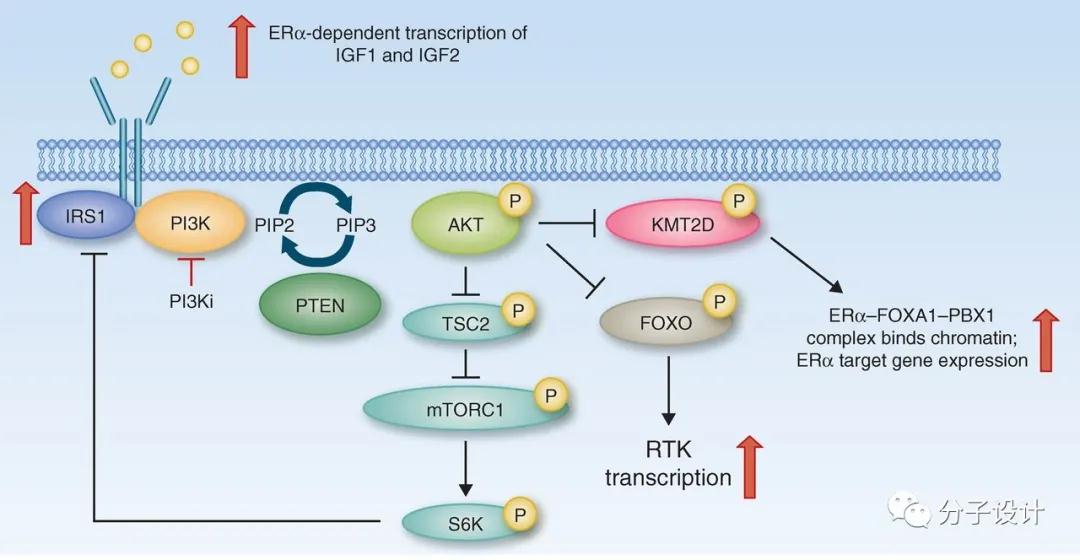
磷脂酰肌醇3-激酶(Phosphoinositide 3-kinase,PI3Ks)是胞内脂质激酶,可催化肌醇第3位的磷酸化(PIP2→PIP3)。与膜结合的PIP3为含有PH结构域的信号转导蛋白提供了靶定锚点,进而介导多种重要信号通路,例如活化下游PI3K/Akt/mTOR信号通路。PI3K通常分为Ⅰ型、Ⅱ型、Ⅲ型3 类。其中,Ⅰ型分为IA型和IB型, IA型由受体酪氨酸激活,根据催化亚基p110的不同又可分为PI3、PI3Kβ 和PI3Kδ 3个亚型;编码PI3Kα的基因PIK3CA突变是肿瘤发生中最常见的突变,这使PI3Kα成为药物研发领域中极为重要的靶点。
然而,尽管做出相当大的努力,迄今为止,以PI3K抑制剂为基础治疗实体瘤的临床结果一直令人失望。只有2019年5月FDA批准的治疗乳腺癌的药物,Alpelisib;第二个有希望的GDC0077正在进行临床试验。这些药物都是典型的ATP竞争性的,因为PI3K异构体中ATP结合位点几近一致,严重的浓度依赖性副作用是常见的。从结构上理解生理条件下的PI3Kα激活机制,以及激活癌基因突变、联合突变的存在,将对创新型药物的研发大有裨益。更重要的,研究发现,当靶向PI3Kα原癌基因时,Alpelisib能够有效地影响特定突变组合的信号强度,这也向科学家抛出了该药物如何发挥作用的难题。
鉴于此,我们本次聚焦PI3Kα,详尽回顾历来PI3K抑制剂的抑制机制及其特定药物发现过程中遇见的挑战,并提出了新的PI3Kα抑制剂开发策略:i) 正构与变构抑制剂的联合使用;ii) 挽救突变指导药物的发现。
(一) PI3Kα的激活机制
在质膜上,PI3K通过与RTK、RAS相互作用被激活。RTK将PI3Kα招募到膜上并促进其产生nSH2结构域自抑制解除的构象变化,从而暴露PI3Kα的活性位点;Ras在其中的作用仅是将脂质底物PIP2稳定在相对较浅但可被PI3Kα容纳的活性位点。因此,Ras介导的变构效应对PI3Kα激活影响不大。
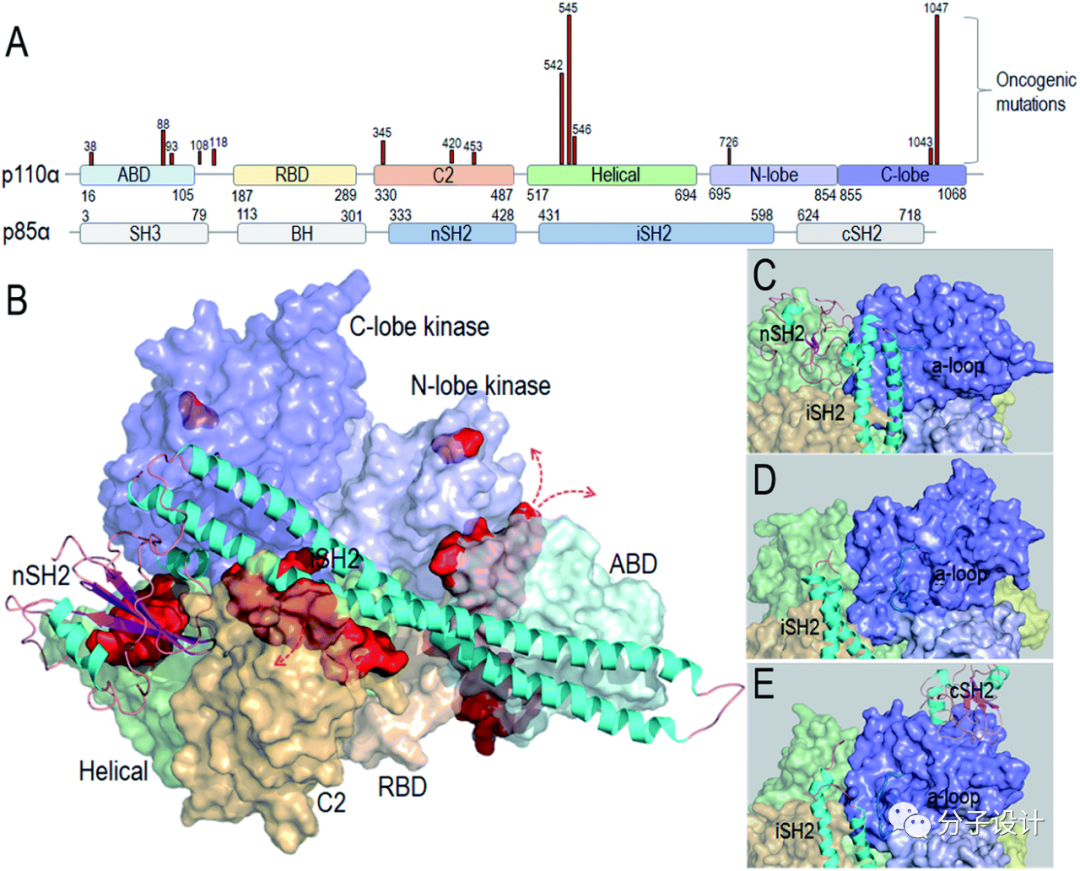
当前,已知具有肿瘤驱动特征的PI3Kα突变造成异常激活机制的大同小异。例如,PI3Kα上的E542K和E545K可以模拟RTK解除PI3Kα自抑制效应;H1047R则模拟RAS在PI3Kα激活过程的作用机制。如上图所示,这些突变主要发生在螺旋域和激酶结构域(深红部分),对PI3Kα活性影响较大,属于强突变;而存在于ABD和C2结构域表面的突变(浅红部分)属于弱突变。最近的临床研究发现,许多病人同时存在多突变,大部分是一个强热点突变与一个或多个弱激活突变配对,如E453Q/K,E726K和M1043V/I,共同激活PI3Kα。
由于ATP结合位点在PI3K多个亚型中的高度一致性,PI3K抑制剂的药物研发一直被选择性不足所阻碍,如何获得高特异、低毒害的抑制剂药物此时显得尤为必要。随着变构等药物研发新技术的发展,靶向另一种变构位点使得高同源蛋白的选择性抑制剂成为可能,这鼓舞着药物科学家们努力探索PI3Kα新的可靶向变构位点。
(二) PI3K抑制剂
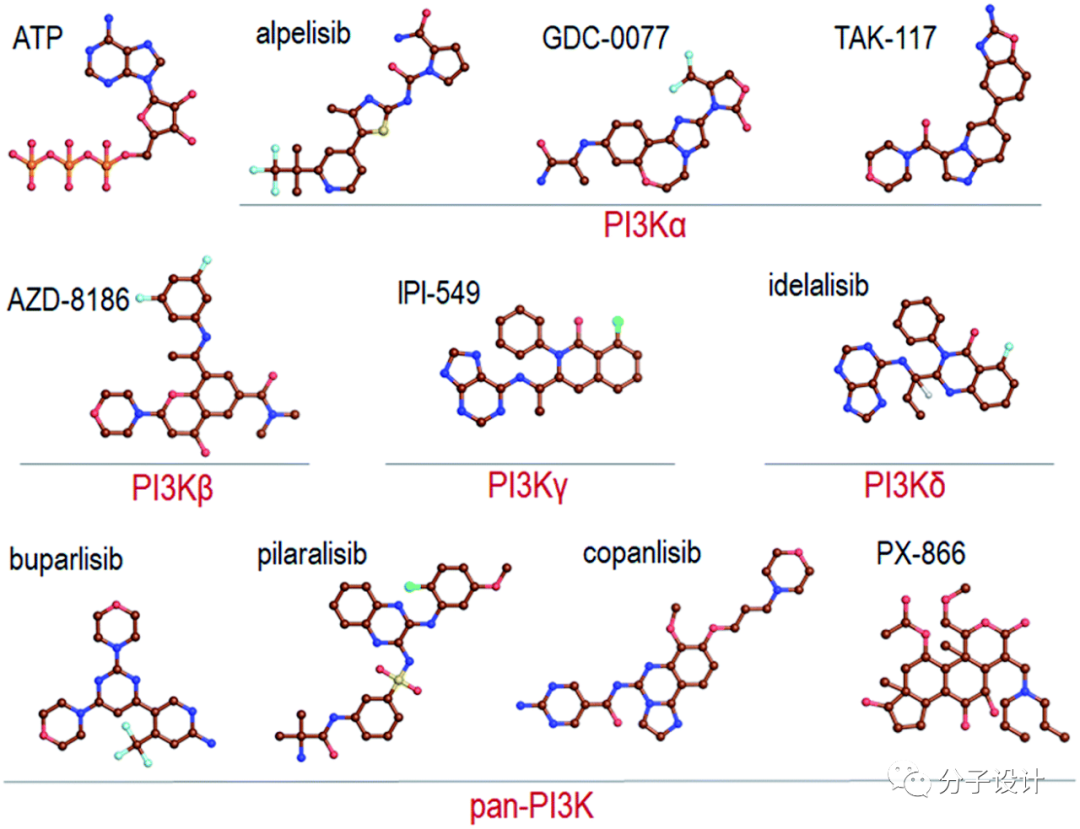
Pan-PI3K抑制剂可作用于所有亚型蛋白,它们缺乏对单一亚型的针对性,因此具有不同程度的潜在毒性,大多数已经停止研发。与之相反的,趋向于特异亚型的抑制剂具有较小的脱靶毒性。2019年,FDA批准了首个PI3Kα的特异性药物Alpelisib,作用于PI3K p110α的正构位点,其联合内分泌疗法Fulvestrant(氟维司群)用于携带PIK3CA基因突变、激素受体(HR)阳性、人表皮生长因子(HER2)阴性、接受内分泌治疗方案期间或之后进展的晚期或转移性乳腺癌患者(包括绝经后女性和男性)。除此之外,Alpelisib还发现可以与BRAF抑制剂encorafenib 和anti-EGFR单克隆抗体cetuximab共同用药被可以降低毒性,临床疗效较好。但值得注意的是,Alpelisib与其他,如靶向PI3K通路的蛋白抑制剂,组合用药评价后发现依然具有副作用。
(三) PI3Kα的正构及其它潜在位点
PI3K各亚型中的ATP结合位点均位于激酶结构域的两个结构单元(lobe)之间,这两个结构单元被一个铰链(hinge)分开。I型PI3K的ATP结合位点高度同源,只有几个边缘的残基不同。这些残基可进一步划分为两个区域,第一个邻近铰链区(四个残基),第二个是位于P-loop处的较小的可变区。这两个区域的非保守残基有助于增强抑制剂的选择性。对于PI3Kα,铰链非保守区是关键。抑制剂GDC-0326就延伸到该区域,其酰胺组成与Gln859相互作用,Ser854也与此抑制剂形成氢键,稳定抑制剂的结合。我们以Alpelisib,解析该位点可抑制的关键相互作用。
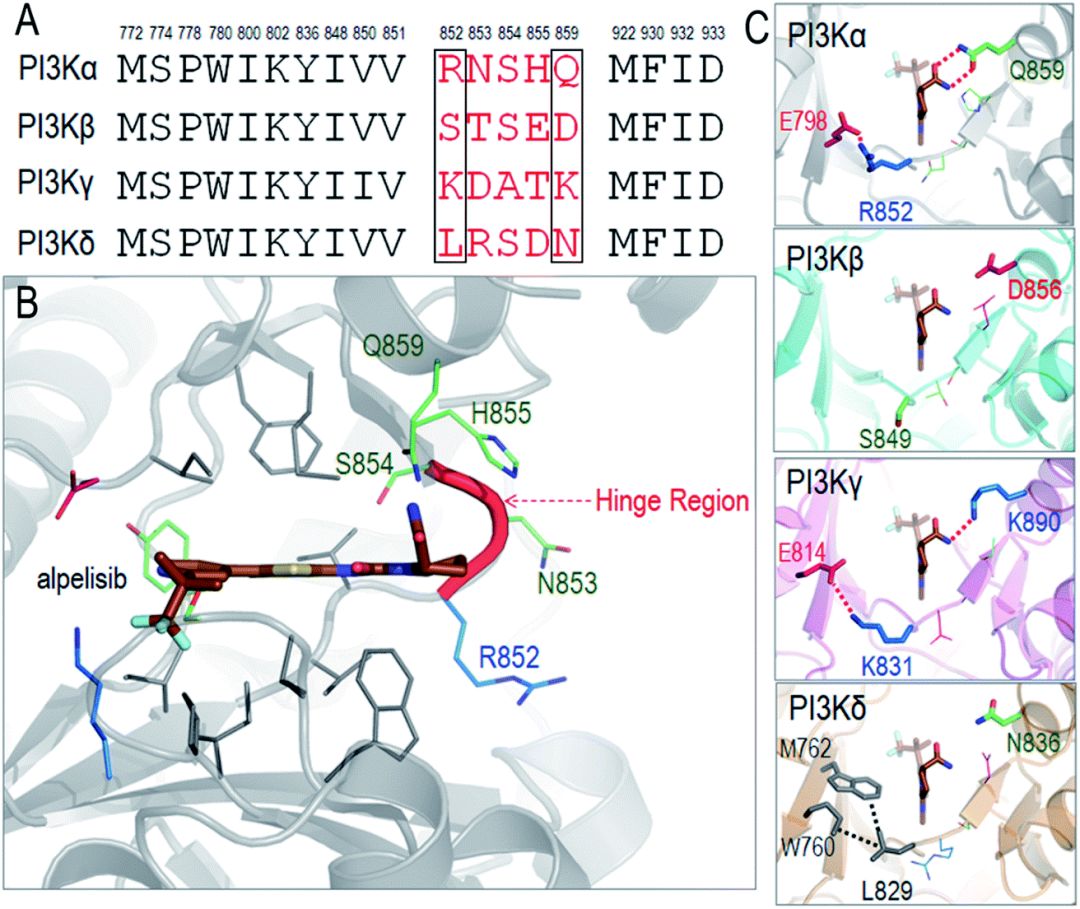
Alpelisib靶向ATP结合位点,并与P-loop和铰链区形成大量相互作用。该位点中与Alpelisib接触的残基大多是家族保守的,只有铰链区五个残基(R852,N853,S854,H855和Q859)具有一定差异性。在该药物的设计中值得关注的是R852和Q859两个残基,因为其他三个残基的侧链都暴露在溶剂中,几乎不参与形成与Alpelisib的相互作用。R852可以与激酶结构域N-lobe中的E798形成盐桥,在PI3Kγ(K831-E814)中也观察到类似的盐桥作用,而PI3Kβ中对应的S849则完全没有类似的相互作用的建立。Q859与Alpelisib可以形成双氢键,对亚型选择性具有重要地位。该残基在PI3Kβ(D856)和PI3Kδ(N836)变得较短,在PI3Kγ(K890)中依然足够长,可以参与氢键的形成。因此,这些差异性可能是Alpelisib对PI3K不同亚型的选择性的关键。Alpelisib对PI3Kα(~5 nM)的IC50值最好,其次是PI3Kγ(~250 nM),PI3Kδ(~290 nM)和PI3Kβ(~1200 nM),这强调了铰链区域在介导亚型选择性中的重要作用。
由于ATP结合位点的正构抑制剂与ATP位点的结合是较不稳定的,需要高的给药浓度来弥补,随之而来的是脱靶效应带来的较高毒副作用。进而,当部分PIP2脂质牢固地锚定在膜上的时候,底物结合位点较浅,不利于抑制剂的长时间稳定存在。因此,寻找其他的变构位点进行PI3K抑制剂的研发可以开辟新的方向。
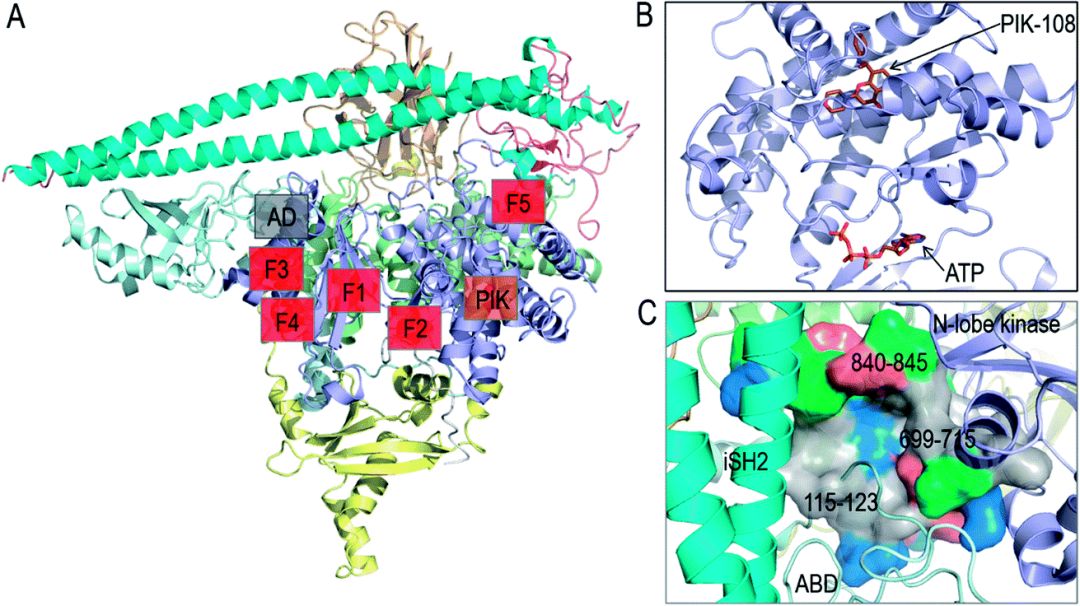
为了寻找变构位点,一些研究机构通过基于片段的筛选,鉴定出在E542K和E545K突变处存在多个可与磷酸肽结合的变构抑制位点(F1-F5),其中位于ABD和激酶结构域N-lobe之间的变构位点最具潜力。该口袋较深且具有相当的疏水性,靶向该口袋的抑制剂有望结合在ABD和iSH2的界面,从而以稳定PI3Kα在失活构象。
(四) PI3Kα抑制剂展望
由于正构位点的保守性,利用变构技术来设计PI3Kα亚型特异性抑制剂是未来的一个替代策略和考虑。该技术涉及变构位点的识别(包括表面和隐式变构位点)和变构小分子药物的设计。变构小分子可根据位点结构设计“Anchors” 和“Drivers”片段连接组成。其中,Anchors负责结合到变构位点,其构象在蛋白非活性和活性状态的过渡期间保持不变,而Drivers “拉”和/或“推”蛋白质原子,使蛋白受体演变为其处于抑制的非活性构象。
Imatinib是一种正构ATP竞争型的药物,可以抑制BCR-ABL的致癌突变。然而,突变往往会影响BCR-ABL的ATP结合位点的理化性质,致其耐药。其中T315取代引起的与药物的空间冲突是最为显著的。Gray的团队,经过筛选、优化得到的GNF-5变构化合物,可稳定结合在BCR-ABL C端的豆蔻盐口袋,与口袋周围残基形成相当多的疏水、vdW相互作用和水介导的氢键。GNF-5也可调整BCR-ABL的构象,使其活性位点对imatinib 和nilotinib重新敏感。这个有效的正构与变构药物联合用药的概念有可能未来在PI3Kα上进行的尝试。
参考文献
[1] Zhang, M., Jang, H., & Nussinov, R. (2020). PI3K inhibitors: review and new strategies. Chemical science, 11(23), 5855–5865. https://doi.org/10.1039/d0sc01676d
[2] Ni, D., Li, Y., Qiu, Y., Pu, J., Lu, S., & Zhang, J. (2020). Combining Allosteric and Orthosteric Drugs to Overcome Drug Resistance. Trends in pharmacological sciences, 41(5), 336–348. https://doi.org/10.1016/j.tips.2020.02.001



 110102000668(1)号
110102000668(1)号